Activite 1 la pile electrique

3e ..
Séquence 5 : Création d’un véhicule
programmable
Collège L. Pasteur
St Mars la Jaille
FICHE ACTIVITE n°1
Nom
Prénom
« Comment fonctionne une pile ? »
1
Dans cette activité, on s’intéresse à la partie Alimenter de notre chaîne d’énergie/chaîne
d’information.
Vous avez vu en physique-chimie le symbole de cet élément :
La question que nous nous posons aujourd’hui est la suivante : Comment cette énergie électrique est-
elle créée ?
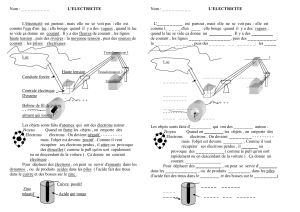
Nous allons tenter une autre expérience pour essayer de comprendre le fonctionnement d’une pile :
vous avez à disposition les éléments qui vont vous permettre de vérifier votre hypothèse.
- Des pièces (centimes) en partie cuivrées
- Des morceaux de zinc (pointe)
- Des demi-citrons
Avec ces éléments vous devez constituer une pile !!
Le cuivre est un élément en manque d’électrons, il a donc une polarité positive car les
électrons sont des charges négatives
Le zinc est un élément en surplus d’électrons, il a donc une polarité négative.
En faisant l’expérience et en plongeant le cuivre et le zinc dans un bain acide , vous avez permis le
transfert d’électrons entre les deux éléments.
Les électrons vont du pôle + vers le pôle –
Mesurez la tension de la pile en citron avec le voltmètre entre les deux bornes + et - :

3e ..
Séquence 5 : Création d’un véhicule
programmable
Collège L. Pasteur
St Mars la Jaille
FICHE ACTIVITE n°1
Nom
Prénom
« Comment fonctionne une pile ? »
2
Une fois cela effectué, nous allons voir s’il est possible d’allumer une simple LED comme celle-ci :
Faire un schéma électrique de la solution que vous proposez :
Indice : En plaçant les piles en série…. Vous allez additionner les tensions et la LED aura alors une
chance de s’allumer.
Formez 4 binômes (de cette manière vous aurez 4 demi-citrons ou 4 piles). Refaites un schéma de
l’expérience et réessayez :

3e ..
Séquence 5 : Création d’un véhicule
programmable
Collège L. Pasteur
St Mars la Jaille
FICHE ACTIVITE n°1
Nom
Prénom
« Comment fonctionne une pile ? »
3
Explication :
un manque d'électrons possède une charge positive, donc une polarité positive
un surplus d’électrons possède une charge négative, donc une polarité positive.
Lorsqu’on branche les pôles de la pile, de minuscules particules chargées négativement,
les électrons, se déplacent dans le circuit. Cette circulation (le flux) d’électron est le courant
électrique.
Comme dans une batterie ou pile conventionnelle, de l’énergie chimique est transformée
en énergie électrique dans la «pile citron».
D’où proviennent les électrons?
L’acide citrique (contenu dans le jus de citron) est ce qu’on appelle un électrolyte. C'est-
à-dire un milieu qui attire les ions des métaux et dans lequel ils peuvent circuler. Les ions
sont des petites particules chargées positivement ou négativement. Les particules
chargées négativement sont les électrons. Le zinc est un métal qui perd facilement des
électrons et le cuivre en accepte facilement. Dans le liquide (le citron), les électrons
quittent le zinc pour aller au cuivre.
Les électrons s’accumulent sur le fil de cuivre qui devient chargé négativement alors que
le clou en zinc est en déficit d’électrons et devient chargé positivement. Il se crée une
différence de tension électrique entre le clou de zinc et le fil de cuivre. Si on les relie avec
un fil conducteur (qui laisse passer le courant), les électrons vont être attirés par la borne
positive et circuler dans ce fil. Cela va générer le courant électrique. Maintenant, si on
place une LED entre le clou et le fil de cuivre, les électrons vont allumer la diode en la
traversant.
Attention, le courant circule dans le sens inverse des électrons. Ce courant circule
uniquement lorsque le circuit est complètement fermé. C’est-à-dire qu'il y a aussi un
tranfert d'électrons dans le liquide (l'électrolyte). Pour chaque électron qui circule à travers
la diode, une molécule chargée négativement doit passer en sens inverse par l'acide
citrique. Par conséquent, la LED s'allume seulement lorsque le clou et le fil de cuivre
trempent dans le citron.
1
/
3
100%