Données - Canalblog

Classe : Tale S Bac Blanc 08 Avril 08
- 1 -
Nom du professeur : PIERRE Classe :TS
Matière : Physique chimie Durée : 3 h 30
Nombre d’exemplaires (par classe) : …….
Date : 08/04/08
Calculatrice autorisée : oui mbre de pages : ……12…..
Exercice 1 ( 8 pts) L’HYDROGÈNE UN COMBUSTIBLE D’AVENIR ?
Les trois parties peuvent être traitées indépendament.
PREMIÈRE PARTIE : LA FUSION NUCLÉAIRE CONTRÔLÉE
Depuis plusieurs années des recherches sont menées en Europe sur les réactions de fusion nucléaire contrôlées. Elles
concernent principalement les isotopes de l’hydrogène : le deutérium et le tritium.
Le mélange réagissant doit être porté à très haute température, d’où l’expression énergie thermonucléaire désignant
l’énergie libérée dans ce type de réactions.
À long terme, l’énergie thermonucléaire pourra remplacer l’énergie des centrales à fission actuelles.
Données:
Particules
Neutron
Proton
Électron
Symbole
1
0n
Hou p 1
1
1
1
0
1e
Masse en kg
1,674 929 × 10–27
1,672 623 × 10–27
9,109 390 × 10–31
Masse en u
1,008 66
1,007 28
0,000 55
Noyaux
Hydrogène 1
Deutérium
Tritium
Hélium 3
Hélium 4
Symbole
1
1H
Dou H 2
1
2
1
3
1H
3
2He
4
2He
Masse en u
1,007 28
2,013 55
3,015 50
3,014 93
4,001 50
Unité de masse atomique
u = 1,660 54 10–27 kg
Énergie de masse de l’unité de masse atomique
E = 931,5 MeV
Électronvolt
1 eV = 1,60 10–19 J
Mégaélectronvolt
1 MeV = 1 106 eV
Vitesse de la lumière dans le vide
c = 3,00108 m.s-1

Classe : Tale S Bac Blanc 08 Avril 08
- 2 -
1. Éléments et noyaux : On représente le noyau d’un atome X par le symbole
X
A
Z
1.1. Que représentent les deux symboles A et Z ?
1.2. Par quoi différent les isotopes d’un même élément chimique?
1.3. Donner la composition du noyau de deutérium.
1.4. Nommer un isotope du deutérium et donner la composition de son noyau.
2. Réactions nucléaires :
Actuellement les recherches sont menées sur un mélange deutérium – tritium ; plusieurs réactions nucléaires sont possibles.
Par exemple, avec 2 noyaux de deutérium, on peut avoir la réaction (1) :
2
1H
+
2
1H
1
1X
A
Z
+ neutron
ou la réaction (2) :
2
1H
+
2
1H
2
2X
A
Z
+ proton
Pour chacune de ces réactions (1) et (2), donner le nom et le symbole des noyaux formés :
1
1X
A
Z
et
2
2X
A
Z
.
3. Conditions :
Pour qu’une réaction de fusion puisse se produire entre deux noyaux, il faut qu’ils soient très proches.
Il faut donc vaincre leur répulsion coulombienne.
3.1. Expliquer l’expression «la répulsion coulombienne».
3.2. Quel est le signe de la charge électrique des noyaux de deutérium et de tritium?
4. Courbe d’Aston :
Au cours des chocs, les noyaux sont dissociés en nucléons séparés puis de nouveaux noyaux sont formés. Il faut donc
fournir de l’énergie au noyau pour le dissocier. Cette énergie comptée positivement est au moins égale à l’énergie de liaison
des noyaux. Plus le noyau contient de nucléons, plus l’énergie de liaison est importante.
4.1. Rappeler la définition de l’énergie de liaison EL.
4.2. Calculer en mégaélectronvolt (MeV) l’énergie de liaison du noyau de tritium.
4.3. Pour comparer la stabilité des noyaux entre eux, on utilise l’énergie de liaison par nucléon. La courbe d’Aston donnée
en annexe 1 représente l’opposée de l’énergie de liaison par nucléon (
L
E
A
) en fonction du nombre de nucléons A.
Indiquer sur la courbe, par des hachures, la zone où l’on trouve les noyaux les plus stables.
4.4. Parmi les réactions de fusion possibles dans les « tokamaks », la réaction entre le deutérium et le tritium libère le plus
d’énergie. La réaction (3) s’écrit:
2
1H
+
3
1H
41
20
He n
.
L’énergie de liaison par nucléon du noyau de tritium est d’environ 2,8 MeV.
4.4.1. Repérer sur la courbe la place du noyau de tritium.
4.4.2. Comparer à partir de la courbe d’Aston l’énergie de liaison par nucléon de
4
2He
aux énergies de liaison de
2
1H
et
3
1H
. Montrer que l’énergie libérée par la réaction (3) vaut 17,4 MeV. Dégager l’intérêt énergétique de cette réaction.
DEUXIÈME PARTIE : L’ÉLECTROLYSE DE L’EAU
La production de dihydrogène en vue d’une utilisation énergétique semble avoir de l’avenir, que ce soit avec les piles à
combustibles ou les moteurs à combustion interne.

Classe : Tale S Bac Blanc 08 Avril 08
- 3 -
Le dihydrogène peut être produit par électrolyse. L’objet de cet exercice est d’en étudier la production.
Dans l’industrie on utilise de l’eau pure afin d’éviter que des impuretés perturbent le fonctionnement de l’électrolyse. La
cellule d’électrolyse (ou électrolyseur) est constituée de deux électrodes (cathode et anode) et d’un électrolyte ; un
générateur de tension continue maintient une tension de l’ordre de 2 V permettant d’avoir une intensité du courant électrique
de plusieurs kiloampères.
L’équation de la réaction qui a lieu est : 2 H2O(l) = 2 H2(g) + O2(g)
1. Étude de l’électrolyse :
1.1. La réaction qui a lieu dans l’électrolyseur est-elle une réaction spontanée ? Justifier votre réponse.
1.2. Les couples d’oxydoréduction qui participent à l’électrolyse sont ° O2(g) / H2O(l) et H+(aq)/ H2(g). Écrire les demi-
équations électroniques correspondant à la formation du dihydrogène et du dioxygène.
1.3. À quelle électrode se dégage le dihydrogène : cathode ou anode ? Justifier votre réponse.
1.4. Compléter le schéma de principe de l’électrolyseur (donné en annexe 2).
2. Intensité du courant dans l’électrolyseur :
À l’instant t0 = 0, on démarre l’électrolyse. On cherche à connaître l’intensité I du courant qui circule dans l’électrolyseur et
qui permet d’avoir une production horaire de dihydrogène de 5 m3.
À un instant t, la valeur absolue de la charge électrique Q transportée dans l’électrolyseur est donnée par la relation Q =I t
avec t = (t - t0).
2.1. On considère la demi-équation électronique correspondant à la formation du dihydrogène. On appelle x l’avancement à
l’instant t de la formation du dihydrogène. Donner la relation entre la quantité de matière de dihydrogène formée n(H2) et
l’avancement x.
2.2. Donner la relation entre la quantité d’électrons mise en jeu ne et l’avancement x à l’instant t.
2.3. Donner l’expression de la valeur absolue de la charge électrique Q à l’instant t, en fonction de l’avancement x.
2.4. En utilisant les relations précédentes, exprimer l’intensité I du courant qui a circulé dans l’électrolyseur en fonction de
n(H2) , F et t .
2.5. On rappelle que la quantité de matière d’un gaz est proportionnelle au volume occupé par le gaz:
2
2molaire
V(H )
n(H ) V
Calculer la valeur de l’intensité I du courant qui circule dans l’électrolyseur quand le débit horaire de dihydrogène est de 5
m3.
Données : Dans les conditions de l’électrolyse : Vmolaire = 25 L.mol-1 ; Faraday : 1 F = 9,65 104 C.mol-1.
TROISIEME PARTIE : LA PILE A COMBUSTIBLE
Le principe des piles à combustible a été découvert par William Growe en 1839, mais leur utilisation réelle ne date que des
années 1960, à l'occasion des programmes spatiaux de la NASA.
Ces piles alimentaient en électricité les ordinateurs de bord des vaisseaux Gemini et Apollo et fournissaient l'eau de
consommation. En effet, par comparaison aux piles salines et alcalines, les piles à combustible, type hydrogène-oxygène
présentent deux avantages : faire appel à des réactifs (dioxygène de l'air et dihydrogène) disponibles en grande quantité et
être non polluantes car libérant de l'eau.
Le principe de fonctionnement est simple : la cellule de réaction est composée de deux électrodes séparées par un électrolyte
(exemple : l'acide phosphorique H3PO4). Elle est alimentée en dihydrogène et en dioxygène en continu.
Le fonctionnement de la pile repose sur une réaction d'oxydo-réduction au niveau des électrodes.

Classe : Tale S Bac Blanc 08 Avril 08
- 4 -
Données : MH = 1,0 g.mol-1 ; MO = 16,0 g.mol-1; Faraday : 1 F = 9,65 104 C.mol-1.
I) Schéma de la pile à combustible :
1) Quel est la nature des porteurs de charges à l'extérieur de la pile ?
2) Légender le schéma de la pile ci-après en indiquant le sens conventionnel de circulation du courant électrique I et le sens
de circulation des porteurs de charges à l'extérieur de la pile. (En ajoutant des flèches bien orientées) (Annexe 3 ).
II ) Les couples d'oxydoréduction mis en jeu dans la réaction sont : H+(aq) / H2 (g) et O2 (g) / H2O (l).
1) Ecrire les demi-équations électroniques pour chaque couple quand la pile débite.
2) En déduire l'équation de la réaction modélisant la transformation ayant eu lieu dans la cellule de réaction.
III ) Le réactif qui est réduit est appelé le "comburant" de la pile.
1) Parmi les espèces chimiques présentes dans les couples, laquelle constitue le comburant ? Justifier la réponse en
définissant la réaction de réduction.
2) L'électrode où se produit la réduction est-elle le pôle positif ou négatif de la pile ? Justifier ?
IV ) Dans un véhicule motorisé fonctionnant grâce à une pile à combustible, on estime à 1,5 kg la masse de
dihydrogène nécessaire pour parcourir 250 km.
1) Calculer la quantité de matière de dihydrogène n(H2) correspondant à cette masse, puis le volume de dihydrogène V(H2)
en mètre-cube (m3) si le volume molaire Vm =24 L.mol-1
2) Justifier le fait que les piles à combustible ne soient pas encore utilisées dans les voitures, en utilisant la réponse à la
question IV ) 1).
3) Rappelons la loi des gaz parfaits : P.V = n.R.T avec :
P (pression du gaz) ; V (volume du gaz) ; n (quantité de matière du gaz) ;
R ( constante des gaz parfaits) ; T (température du gaz)
Proposer un moyen de réduire l'espace occupé par ce gaz, à température ambiante pour la quantité de matière n de gaz
calculée précédemment. Justifier à l'aide de la loi précédente.
V ) Dans la navette spatiale, les piles à combustible débitent un courant d'intensité I=200 A.
1) Calculer la charge électrique Q libérée en 24 heures.
2) En déduire la quantité de matière nP des porteurs de charge, ayant circulé dans le circuit de la navette pendant 24
heures et la quantité de matière n(H2) de dihydrogène consommée.
Exercice 2 (7pts) : RECHERCHE D’UN MODÈLE DE FORCE DE FROTTEMENT
Données pour l’exercice :
Volume de la bille en acier : V = 0,52 cm3
Masse volumique de l’acier : A = 7850 kg/m3
Masse volumique de l’huile : H = 920 kg/m3
Accélération de la pesanteur au lieu de l’expérience : g = 9,8 m/s²
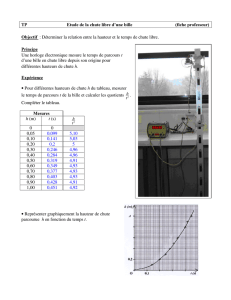
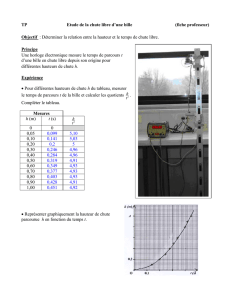
On réalise la chronophotographie de la chute d’une bille sphérique en acier dans l’huile. Pour
ce faire, on filme la bille dans une éprouvette remplie d’huile, avec un caméscope numérique au rythme de 50 images par
seconde. Grâce à un traitement adéquat des images, on obtient le document 1 (voir en fin de sujet). On repère ensuite la
position, sur chaque image, du centre d’inertie de la bille : M0 correspond à sa position initiale, celle-ci étant lâchée, à
l’instant t0 pris comme origine des dates, sans vitesse initiale.
A. Exploitation de l’enregistrement
A-1. En vous aidant des documents 1 et 2 (en fin de sujet), préciser les caractéristiques du
mouvement de la bille entre les positions M15 et M21. Quelle est la loi de Newton ainsi
illustrée ?
A-2. A partir des conditions de prise de vue données ci-dessus, justifier les valeurs qui
apparaissent dans la colonne temps t (ms) du tableau du document 2.
B. Étude cinématique

Classe : Tale S Bac Blanc 08 Avril 08
- 5 -
Le point M0 étant pris comme origine des espaces et des temps (y = 0 et t = 0), on repère les différentes hauteurs réelles de
chute de la bille dans l’huile, notées y, aux dates t correspondantes. On calcule alors les vitesses correspondantes. Les
différentes grandeurs sont notées dans le tableau du document 2.
B-1. Calculer la vitesse de la bille pour la position M6.
B-2. Calculer l’accélération de la bille pour la position M18. Le résultat obtenu est-il
compatible avec celui obtenu au A-1 ? Argumenter la réponse.
NB : Pour les questions B-1 et B-2, on aura soin de préciser scrupuleusement la méthode employée pour déterminer les
valeurs de la vitesse et de l’accélération aux points demandés.
C. Étude dynamique
C-1. Sur un schéma, faire figurer, sans souci d’échelle, toutes les forces s’exerçant au centre
d’inertie G de la bille tombant dans l’huile.
C-2. Calculer la masse m de la bille.
C-3. Donner l’expression littérale de la poussée d’Archimède, PA, s’exerçant sur la bille
plongée dans l’huile. Calculer sa valeur.
D. Équation différentielle du mouvement de la bille
Soit f l’intensité de la force de frottement à laquelle est soumise la bille en mouvement dans
l’huile.
D-1. Par application du théorème du centre d’inertie que l’on énoncera, établir que le
mouvement de la bille obéit à une équation différentielle du type :
dt
dv
+
m
f
= A, où A est une constante et v
la vitesse de la bille.
D-2. Donner l’expression littérale de A puis calculer sa valeur. Préciser son unité.
E. Recherche de modèles pour la force de frottement
On se propose de déterminer expérimentalement si l’intensité de la force de frottement f à
laquelle est soumise la bille en mouvement dans l’huile est de la forme f = k1 . v ou f = k2 . v²,
k1 et k2 étant des constantes et v la vitesse de la bille.
On utilise un tableur pour représenter la vitesse de la bille en fonction du temps. On obtient le graphe du document 3 (en fin
de sujet) : les points expérimentaux obtenus y sont représentés sous forme de losange. On détermine ainsi la valeur de la
vitesse limite de chute de la bille : vlim = 0,95 m/s.
E-1. Première hypothèse : f = k1 . v
E-1.a) Montrer que l’équation différentielle précédente peut alors se mettre sous la
forme :
dt
dv
+
.vB1
= A où A est la constante déterminée dans la partie D.
E-1.b) Lorsque la vitesse de la bille atteint la vitesse limite vlim, que devient le terme
dt
dv
de l’équation différentielle précédente ? En déduire l’expression littérale de
B1 en fonction de A et vlim . Calculer alors la valeur de la constante k1 et
préciser son unité.
E-2. Deuxième hypothèse : f = k2 . v²
Dans ce cas, l’équation différentielle se met sous la forme :
dt
dv
+
2
2.vB
= A
Déterminer l’expression littérale de B2 en fonction de A et vlim. Calculer alors la valeur
de la constante k2 et préciser son unité.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%