Agents infectieux - Faculté de médecine vétérinaire

Pathologie de la faune 2001 Daniel Martineau
86
(Michigan), remplie d'orignaux. Depuis lors, cette population a été précieuse pour l'étude de l'équilibre
prédateur-proie. C'est là notamment qu'on a découvert que les loups choisissent principalement les
jeunes et les vieux orignaux comme proies et non les adultes en santé. Cet écosystème préservé a
permis récemment de découvrir que c'est la densité des loups qui détermine la croissance des plantes
(top-down model) en contrôlant la densité des orignaux (voir Isle Royale, p. 14).
La population de loups a diminué fortement depuis les années 1980. On croit que c'est à cause du virus
du distemper qui a été apporté par les bottes d'un visiteur. Encore ici, l'analyse de l'ADN des loups a
révélé que les animaux avaient la moitié de la variabilité génétique de loups normaux (ils descendraient
tous de la même femelle).
Baleine à bosse
Les baleines à bosse migrent plus que 10,000 km chaque année de leur habitat d'été, où elles se
nourrissent, à leur habitat d'hiver, où elles s'accouplent. La chasse a fait passer leur nombre de 125,000
à moins de 5,000, avant que la protection internationale ne leur soit accordée en 1966. On a déterminé
par analyse de l'ADN mitochondrial que les baleines à bosse habitant les trois océans séparés par des
continents ont divergé génétiquement de 3 à 5 millions d'années auparavant. Puisqu’on peut encore
discerner ces différences, on peut dire que la diminution des stocks due à la chasse n'a pas entraîné de
bottleneck comme cela a été le cas pour le guépard (il peut y avoir eu bottleneck avant 5 millions
d'années!).
Agents infectieux
Virus
Rage
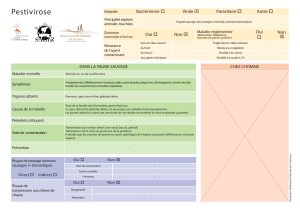
Nom de la maladie. Rage, hydrophobie. La rage est une maladie infectieuse qui se traduit par
l'inflammation du cerveau (encéphalite) causée par un virus transmis le plus souvent par la morsure
d'un animal infecté ou par la contamination d'une plaie cutanée par de la salive infectieuse. Bien que
ces modes de transmission soient moins fréquents, la rage se transmet aussi par la voie orale, oculaire
ou par les membranes muqueuses.
Agent causal : le virus de la rage appartient au genre Lyssavirus, et à la famille des Rhabdoviridae. Les
particules ont la forme d'une balle de fusil, ont environ 180 nm de long et 75 nm de diamètre avec un
génome constitué d'une molécule ARN à simple brin, de polarité négative, entouré par une enveloppe
de phospholipides. La protéine G est répartie sur la surface de l'enveloppe. C'est elle qui permet le
développement de la réaction immune. La rage classique est liée au Lyssavirus Sérotype 1 : elle est
responsable de la rage des mammifères terrestres et des chauves-souris insectivores et hématophages
du Nouveau-Monde. Les Sérotypes 2, 3 et 4 ont été isolés chez des chauves-souris de l'Ancien-Monde,
des musaraignes et occasionnellement dans des maladies ressemblant à la rage chez les animaux de
compagnie et chez l'homme en Europe et en Afrique.
On croyait qu'il s'agissait d'une seule entité. On s'aperçoit maintenant que le "virus de la rage" est en fait
un ensemble de variants très différents les uns des autres, et chaque variant persiste dans un hôte
spécifique.
Distribution. Au Québec, il y a eu 2774 cas confirmés de rage animale de 1986 à 1996. Il y a eu 10
cas en 1999 et 21 en 2000. En octobre 2000, un enfant mourait à Montréal de rage suite à l'exposition
au virus de chauve-souris. C'était le premier cas humain depuis 1964. Voir la carte du Québec réalisée
par le Dr François Lagacé montrant les cas québécois en 2000 à www.amvspq.org
Au Canada, les problèmes de rage proviennent de la faune. Au Québec et en Ontario, les cas
surviennent chez le renard roux et la rage du raton-laveur a fait une entrée récente (47 ratons-laveurs

Pathologie de la faune 2001 Daniel Martineau
87
en Ontario en 2000).
Au Canada, il y a eu moins de 25 cas chez l'homme depuis que l'on tient des registres à cet effet.
Dans les Territoires du Nord-Ouest, il y a des cas sporadiques chez les renards Arctiques et les chiens
de traîneau. On n'a pas rapporté de cas en Colombie-Britannique (Mars 1999).
En Alberta, on rapporte de rares cas. En Saskatchewan et au Manitoba, les cas sont surtout chez la
moufette.
Le virus de la rage est détecté chez tous les mammifères et peut aussi affecter les oiseaux bien que
ces derniers ne jouent pas un rôle important dans l'épidémiologie de la maladie. La rage est observée
sur tous les continents sauf l'Australie et l'Océanie. Certains pays tels que le Royaume-Uni et l'Irlande
en sont totalement exempts. D'autres pays sont indemnes de la rage des animaux terrestres bien que
des chauves-souris enragées soient exemptes. Bien que la rage puisse affecter toutes les espèces de
mammifère, pour une région géographique donnée elle apparaît le plus souvent associée à une unique
espèce. Cette espèce joue le rôle de réservoir de la maladie et la transmet aux autres espèces. Le
réservoir des régions arctiques est le renard arctique (Alopex lagopus), le raton-laveur (Procyon lotor)
l'est dans l'Est des États-Unis et en Ontario, les vampires (et plus spécialement Desmodus rotundus) le
sont en Amérique Centrale et du Sud et le Chien (Canis familiaris) constitue le réservoir de l'Afrique et
de certaines régions d'Asie. La souche présente au Québec est celle liée au renard arctique.
Écologie / Épidémiologie : On croyait que la stratégie du virus de la rage - tuer l'hôte - n'est pas très
bonne. En fait, dans le cas de la rage, la mort de l'hôte n'est pas importante pour le virus.
La stratégie du virus est très efficace puisque la maladie resurgit constamment dans le monde entier et
gagne même du terrain (voir rage du raton-laveur). Après l'inoculation, le virus est presque indétectable.
Il se rend jusqu'au système nerveux central, où il altère le comportement de l'animal pour assurer sa
transmission. Le virus s'assure aussi que l'hôte infecté excrète une grande quantité de virus bien avant
qu'il ne meure.
Les variants persistant au sein des différentes espèces ne s'adaptent pas facilement à d'autres
espèces. Attention ! Ceci ne signifie pas qu'ils ne peuvent pas infecter - et tuer - des animaux
appartenant à d'autres espèces ou l'humain; ceci signifie simplement qu'ils ne persistent pas au sein de
populations animales d'autres espèces. Par exemple, les variants des renards arctiques ne s'établissent
pas au sein des populations de ratons-laveurs, et vice-versa. Ou encore, les variants des chauves-
souris ne s'établissent pas dans les populations de ratons-laveurs ou de renards (mais peuvent
occasionnellement infecter et tuer des ratons-laveurs ou des renards).
La relation qui existe entre le virus rabique et les espèces réservoir est liée à la variabilité génétique du
virus. Ainsi, un raton-laveur qui a la rage mordra surtout d'autres ratons-laveurs. Ceux-ci mordront
d'autres ratons-laveurs qui en mordront d'autres. Ainsi, la période d'incubation du nouveau variant sera
idéale pour permettre au raton-laveur infecté de mordre d'autres ratons-laveurs avant que ce raton-
laveur infecté ne meure.
Cette adaptation permet sans doute au virus de persister au sein d'une population animale donnée
explique ainsi la plus grande "efficacité" de l'infection virale chez l'espèce à laquelle elle est adaptée.
Par exemple, pour induire la maladie il faut administrer moins de virus de la souche du renard arctique
à cette espèce qu'à une autre espèce. De plus, l'infection qui en résulte se développe plus rapidement
et la concentration de virus au niveau de la salive est plus importante chez le renard arctique que chez
les autres espèces. Ces variations dans le virus peuvent expliquer les différences de sensibilité à
l'infection que l'on observe chez certaines espèces de mammifères.
Les variants de virus rabique sont identifiés par l'analyse moléculaire de leur homogénéité génétique ou
par la comparaison des variations mineures de l'antigène G que l'on peut détecter par des anticorps
monoclonaux.
Six génotypes sont maintenant identifiés en Amérique du Nord (Emerging infectious diseases 4:429-
435, 1998).
Le génotype du renard arctique affecte le renard arctique et le renard roux (Vulpes vulpes) des
régions arctiques et sub-arctiques. Au milieu des années 1950, l'aire de distribution de ce variant s'est
étendue et il est devenu endémique chez les renards roux de l'Ontario. A partir de ce nouveau foyer
d'endémie, le virus se propage régulièrement dans les régions adjacentes (Québec, Nouvelle

Pathologie de la faune 2001 Daniel Martineau
88
Angleterre, New York). Périodiquement, ce variant atteint Terre-Neuve à partir du Labrador lorsque
l'océan est pris par la glace.
À part la rage des chauves-souris, le Québec connaît pour l'instant un seul variant rabique : c'est celui
du renard arctique qui, dans la vallée du Saint-Laurent, affecte le renard roux.
Le génotype du raton-laveur
Historique: apparu dans les années 1950 en Floride. Le raton-laveur s'est révélé très sensible à une
variante. Cette variante s'est étendue dans les régions voisines de la Géorgie, de l'Alabama et en
Caroline du Sud. La progression s'est longtemps heurtée à la barrière naturelle de la chaîne des
Appalaches. Mais à la fin des années 1970, des associations de trappeurs ont capturé des ratons-
laveurs (probablement en phase d'incubation) pour les transporter en Virginie (Voir Translocation). À
cause de ces trappeurs, ce variant s'est largement répandu et représente maintenant un danger majeur
pour la santé publique en milieu urbain comme en milieu rural. Il est observé presque partout en
Virginie, Pennsylvanie, Delaware, Maryland, New York (1990), Connecticut, Massachusetts. Le front
rabique s'est déplacé vers le Nord et vers l'Ouest à travers l’État de New York à la vitesse de 50 km par
an depuis 1990 et se trouve à présent au Vermont, à 25 km de la frontière du Québec (septembre
1999). Les deux premiers cas de rage du raton-laveur au Canada étaient signalés dans l'Est de
l'Ontario en juillet 1999.
Ontario: Le 14 juillet 1999, le premier cas de rage causé par une variante du virus associée aux ratons laveurs a été diagnostiqué
chez un raton laveur de l'autre coté du fleuve Saint-Laurent, en face d'Ogdensburg dans l'État de New York, dans un village au
nord-ouest de Prescott en Ontario. Un deuxième cas a été identifié le 26 juillet, 9 miles à l'ouest du premier cas. Un troisième cas
a été diagnostiqué le 17 septembre à environ 9 miles au nord des 2 autres cas. Le ministère des Richesses naturelles de l'Ontario
dirige des programmes de capture-vaccination-relâche depuis un certain nombre d'années aux principaux passages de la frontière
dans les régions du fleuve Saint-Laurent et de Niagara afin de créer des zones défensives de ratons laveurs vaccinés en vue de
minimiser la propagation de l'épizootie de la rage. Ces premiers cas ont été décelés hors de la zone de vaccination. Un total de
880 ratons laveurs, 220 mouffettes rayées et un renard roux capturés dans un rayon de 3 miles des deux premiers cas ont eu un
résultat négatif à la réaction d'immunofluorescence visant à déceler la rage (ministère des Richesses naturelles de l'Ontario,
données non publiées, 2000). Dans un rayon d'environ 3 miles autour du point de contrôle, les ratons laveurs et les mouffettes ont
été capturés dans des pièges permettant de capturer l'animal vivant, le vacciner avec un vaccin inactivé puis le relâcher. Les
ratons laveurs atteints de la rage ont probablement traversé le Saint-Laurent par le pont international entre Ogdensburg-
Johnstown dans l'État de New York et Prescott en Ontario ou
près de ce pont.
Source: Morbidity and Mortality Weekly Report, 49(02): 2508, 21 janvier 2000
Importance: Le danger avec le raton-laveur est que son habitat, contrairement à celui du renard,
chevauche celui de l'homme (villes, aires de picnic et campings). De plus, le raton-laveur est un animal
curieux qui n'a pas très peur de l'humain naturellement.
Le Québec a décidé de se doter d'un Comité interministériel auquel participent :
- Ministère de la Santé,
- Ministère de l'environnement et de la Faune,
- Agriculture Canada,
- Agriculture Québec,
- FMV (Dr. Bélanger).
Différents scénarios ont été évalués par le Comité interministériel sur la rage en fonction de leur coût et
de leurs résultats attendus :
1 - Laisser l'épidémie arriver (et donc s'installer) en informant largement le public des risques de
la rage. Au Maryland, bien que la rage du raton-laveur soit présente depuis 13 ans et bien que de
nombreux traitements humains suite à des expositions aient été nécessaires, on ne note encore
aucun décès du cette maladie.
2 - Vacciner (cette intervention a été retenue en 1999). Vaccination par appâts (vaccin
recombinant) sous la forme d'une bande en avant du front de rage.
Dans le Nord-Est des Etats-Unis, le coût lié à la rage était de 4 $ par an et par personne avant qu'elle n'apparaisse et de près de
10 $ à compter du moment où elle est devenue endémique. Le coût d'une prophylaxie post-exposition est de 400 $ par enfant et
de 500 $ par adulte. En Europe, la rage du renard est bien maîtrisée par la dispersion de vaccins recombinants dans
l'environnement. En Ontario, la dispersion de vaccins modifiés a permis de contrôler l'épidémie.
La biologie du raton-laveur rend la vaccination par appâts plus aléatoire : ne serait-ce que par son
comportement alimentaire, le raton risque de détruire la capsule contenant le vaccin au lieu de l'avaler.
Il faut donc déterminer le pourcentage de ratons protégés après la dispersion de tels appâts. Il faut
aussi savoir si ce pourcentage est suffisant pour enrayer la progression du front. (Les renards et les
ratons-laveurs n'ont pas les mêmes goûts. Pour un vaccin oral placé dans des appâts, il faut donc
mettre au point un appât utilisable à la fois sur le renard et sur le raton-laveur. C'est ce qu'on est en train

Pathologie de la faune 2001 Daniel Martineau
89
de mettre au point en Ontario avec des appâts contenant des émetteurs radio (une combinaison sucre-
vanille fonctionne bien). (En Ontario, on largue des appâts contenant du vaccin pour le renard roux à
partir d'avion). (JWD 34:647-652 (1998).
Une étude en laboratoire a montré que le vaccin recombinant administré par voie orale protège 78 %
des raton-laveurs mais que seulement 43 % des animaux développent des anticorps neutralisants. De
plus, la méthode de marquage des animaux vaccinés (tétracycline) est peu fiable. Il est donc assez
difficile, dans une zone de vaccination orale, de connaître le réel statut d'un animal quant à sa protection
contre la rage.
La vaccination par les appâts recombinés nécessite :
- des études pour déterminer le statut sérologique avant la vaccination,
- un plan de vaccination (dans l'espace et dans le temps),
- un plan de communication détaillé.
Un vaccin a été largué en Estrie en septembre 1999 par voie aérienne pour arrêter la progression de la
rage du raton-laveur à partir de l'État du Vermont et de l'Ontario.
Le génotype de la mouffette
Deux génotypes infectent les moufettes, le premier au centre méridional des États-Unis à l'Ouest du
Mississippi et le second dans les zones situées au Nord du Midwest et dans la région des grandes
plaines (variant nord de la mouflette). Ce dernier variant s'est répandu au Manitoba et au Saskatchewan
au cours des décades passées et il est contenu aux frontières Sud et Est de l'Alberta par un programme
de surveillance. La variant nordique de la Mouffette est aussi observé en Californie, sans doute suite au
transport d'animaux en incubation et la rage du renard gris (Urocyon cinereoargentus) au Texas est
aussi causée par ce génotype. La rage du chien et du coyote (Canis latrans) observées au Texas est
issue d'une invasion à partir du Mexique et elle est aussi due à un virus proche de celui du variant nord
de la mouffette.
Le cinquième génotype est uniquement observé chez le renard gris dans le Sud-Est de l'Arizona.
Génotype de la chauve-souris: En général, l'infection provoque de faibles mortalités chez les
populations de chauves-souris sauvages, et on note de forts taux de séropositivité au sein de ces
populations. Il est donc probable que les chauves-souris développent une réaction immunitaire qui les
protège de la maladie.
Il existe au moins 6 variants distincts de virus des chauves-souris insectivores, chacun de ces variants
étant associé à une espèce particulière. Bien que quelques cas de rage associés à ces variants soient
occasionnellement rapportés chez des espèces autres que les chauves-souris, les variants des
chauves-souris ne s'établissent pas de façon endémique dans les populations d'animaux terrestres.
Ainsi, bien que la rage des chauves-souris existe en Colombie Britannique et qu'un cas de rage lié à un
variant chauve-souris ait été reporté chez un cheval de cette province, la rage terrestre n'y sévit pas de
façon endémique.
En Amérique du Nord, la rage se maintient de façon endémique chez la grande chauve-souris brune
(Eptesicus fuscus), la chauve-souris cendrée (Lasiurus cinereus), la chauve-souris rousse (Lasiurus
borealis), la chauve-souris mexicaine à queue libre (Choeronycteris mexicana) et peut-être chez la
chauve-souris argentée (Lasionycteris noctivagans) et la chauve-souris jaune de Floride (Lasionycteris
intermedius). Chez les autres espèces de chauves-souris et plus spécialement chez Myotis spp., la rage
résulte d'une transmission incidentelle à partir des espèces chez lesquelles elle est endémique.
La grande chauve-souris brune est l'espèce chez laquelle l'infection est la plus souvent retrouvée dans
l'Ouest du Canada et en Ontario. La chauve-souris cendrée et la chauve-souris argentée sont
respectivement les seconde et troisième espèces les plus fréquemment infectées. Dans toutes les
régions, les autres espèces de chauves-souris y compris la petite chauve-souris brune (Myotis
lucifugus) sont rarement rabiques. Les chauves-souris rabiques sont rares dans les Provinces
Maritimes. Des 5 derniers cas de rage humaine diagnostiqués au Canada, 3 étaient liés aux chauves-
souris (Saskatchewan 1970, Nouvelle Écosse 1978, Alberta 1985).
Au Colorado, en 1999, on a déterminé que 30 % des chauves-souris qui mordent les humains ont la rage. Cependant, aucune des
personnes mordues n'a contracté la rage (elles ont presque toutes eu le traitement prophylaxique post-exposition). La plupart du
temps, les circonstances d'une morsure sont une chauve-souris qui se dépose sur quelqu'un. Les chauves-souris qui ont des
interactions avec les humains ont en général de plus fortes chances d'être enragées.
Québec: le 20 octobre 2000. Cas de rage humaine : Québec. Le 27 septembre 2000, un enfant de
9 ans a été admis dans un centre hospitalier de Montréal avec un syndrome rapidement évolutif

Pathologie de la faune 2001 Daniel Martineau
90
compatible avec la rage. Le diagnostic a été confirmé par un test d'immunofluorescence directe sur une
biopsie cutanée et par un test d'amplification génique
(RT/PCR) du virus de la rage sur des spécimens biologiques. Le décès est survenu le 6 octobre 2000
après une détérioration de l'état neurologique. La caractérisation moléculaire de l'acide nucléique a
permis d'associer le virus avec une variante de la chauve-souris argentée. Trois semaines et demie
avant le début des symptômes, l'enfant et sa famille avaient séjourné dans un chalet d'une réserve
faunique de la région des Laurentides située à l'ouest de la province. Une chauve-souris trouvée par
terre dans la salle de bain et qui semblait montrer une certaine difficulté à voler fut retirée du chalet. Il
n'y a pas eu de contact noté avec l'enfant atteint. L'exposition la plus probable, survenue sans doute
durant le sommeil de l'enfant, semble avoir été une éraflure ou morsure au bras qui est passée
inaperçue à ce moment. La prophylaxie postexposition contre la rage a été offerte aux autres membres
de la famille qui avaient aussi séjourné au chalet, à un nombre limité de travailleurs de la santé qui
avaient eu un contact significatif avec la salive du patient et aux compagnons de jeux ou de classe de
l'enfant atteint chez qui on n'a pu exclure un contact de la salive avec une muqueuse ou une plaie.
Sources : Hôpital Sainte-Justine, Hôpital Maisonneuve-Rosemont, Unité Maladies infectieuses de la
Direction de la santé publique de Montréal-Centre, ministère de la Santé et des Services sociaux du
Québec.
Les derniers cas de rage animale au Québec (mai et juillet 1995) concernaient un bovin (Sainte-Hélène,
souche renard) et une chauve-souris d'espèce non précisée (Drummondville).
Amérique du Sud (Chili), les chauves-souris sont le principal réservoir de rage en milieu urbain
(c'était le chien, il n'y a pas bien longtemps). Dans le nord-est du Brésil, les marmousets gardés comme
"pets" sont responsables de quelques "incidents" mortels.
Pathogénie: le virus inoculé dans les tissus pénètre dans les nerfs périphériques et il est transporté de
façon centripète à la moelle épinière et au cerveau. Dans le cerveau, le virus se réplique et passe d'un
neurone à l'autre, infectant de nombreuses zones du cerveau et déclenchant une encéphalite. Le
comportement anormal est dû à l'effet de l'infection des neurones. Après avoir infecté les neurones, les
virus sortent du cerveau (migration centrifuge) par les axones des neurones infectés. Ils se disséminent
par voie nerveuse (et non pas par voie vasculaire) dans l'ensemble de l'organisme. Bien que
disséminés dans de nombreux organes, c'est dans les glandes salivaires que le virus se concentre le
plus, se réplique et est excrété par la salive. Le virus est généralement présent dans la salive au
moment où les signes cliniques apparaissent.
Signes cliniques : La rage doit être suspectée chez tout animal sauvage présentant un comportement
anormal. Il faut particulièrement surveiller : perte de l'instinct de fuite, animal s'approchant des humains,
excitation, agression, observation diurne d'espèces nocturnes, dépression, incoordination, ataxie,
paralysie, convulsions, crampes, vocalisation anormale, incapacité ou difficulté à avaler, ptyalisme. Tout
carnivore ayant attaqué des porcs-épics est suspect de rage.
Chez l'homme, les signes comportent une phase prodromique d'anxiété avec parfois une sensation
anormale au site de pénétration du virus rabique. Par la suite, des signes non spécifiques tels que de la
dépression, du vertige, des maux de tête, peuvent survenir dans les premiers temps de la phase
clinique. Ils sont suivis par de l'excitabilité, de la raideur du cou, de l'hyper-réflexivité, de l'hydrophobie,
des spasmes, de la paralysie et, finalement, la mort survient suite à l’œdème cérébral ou suite aux
complications de pneumonie par aspiration. La rage clinique est toujours fatale.
Diagnostic : chez les animaux, la rage est diagnostiquée par la mise en évidence du virus dans les
cellules nerveuses par immunofluorescence (IF). Le laboratoire a besoin de l'encéphale pour établir le
diagnostic : il est donc important que l'animal suspect de rage ne soit pas sacrifié par une balle dans la
tête.
Si l'IF est négative et s'il y a eu contact humain, des broyats d'encéphale de l'animal suspect sont
inoculés à des cultures de neuroblastome de souris et on recherche de nouveau la présence de virus
rabique par la technique d'IF sur la culture cellulaire. Ce test est plus sensible que l'IF seule. Tous les
diagnostics de rage au Canada sont effectués par les laboratoires d'Agriculture Canada. Les
encéphales d'animaux infectés par la rage peuvent aussi être examinés à l'histologie. Cependant, les
corps de Negri, des corps d'inclusion que l'on retrouve dans les neurones infectés par le virus rabique,
ne sont pas toujours présents chez les animaux rabiques.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
1
/
45
100%