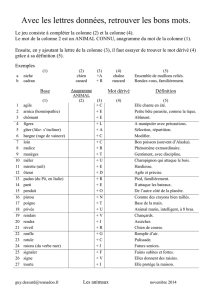
initiation aux formules chimiques

Classe de 3ème – CHIMIE – initiation à l'écriture des formules des corps.
On rencontre maintenant dans la vie de tous les jours des formules correspondant à des corps courants : l'eau H2O , le
gaz carbonique CO2 , sur les bouteilles d'eaux minérales : la composition en sels minéraux avec les ions chlorure Cl-
ou calcium Ca2+ ...
Ci après se trouvent 2 modèles permettant déjà d'écrire correctement la formule de nombreux corps. Tout commence
par l'incontournable tableau périodique des éléments.
1- Tableau périodique des éléments.
Comme tout tableau, il est constitué de lignes et de colonnes.
Dans le sens des lignes, chaque fois qu'on passe d'une case à la suivante de gauche à droite, le nombre de protons de
l'élément augmente de 1 (on ne tient donc pas compte ni des neutrons du noyau ni des électrons qui gravitent autour)
Quel est le nombre de protons du carbone ?
Quel est le nombre de protons de l'azote ?
Dans le sens des colonnes, les éléments font partie d'une même famille, c'est-à-dire qu'ils ont des propriétés
semblables. Ces propriétés semblables sont plus nombreuses dans les colonnes extérieures que dans les colonnes
intérieures.
Ainsi tous les éléments de la colonne 8A sont des gaz qu'on trouve dans l'air. Indiquer 2
éléments de la colonne 8A dite des gaz nobles :
Ainsi tous les éléments de la colonne 1A sont des métaux qui réagissent vivement avec l'eau.
Indiquer 2 éléments de la colonne 1A dite des métaux alcalins :
2- Modèle ionique (valable pour les colonnes 1A sauf H 2A 3A 5A 6A 7A):
Ce modèle dit ceci :
les atomes de la colonne 1A perdent facilement 1 e-, ceux de la colonne 2A perdent facilement 2 e- et ceux de la
colonne 3A perdent facilement 3 e-
les atomes de la colonne 7A captent facilement 1 e-, ceux de la colonne 6A captent facilement 2 e- et ceux de la
colonne 5A captent facilement 3 e-
Exemple :
Mg (colonne 2A) perd facilement 2 électrons et Cl (colonne 7A) capte facilement 1 électron. Il faut donc 2 Cl pour
capter les 2 électrons perdus par Mg. Mg s'associe donc avec 2 Cl pour former une molécule de formule MgCl2
appelée chlorure de magnésium.
Sur le même modèle écrire les formules des corps suivants :
chlorure de calcium
chlorure de sodium
chlorure d'aluminium
oxyde de magnésium
oxyde de sodium
oxyde d'aluminium
fluorure de potassium
bromure de baryum
iodure d'aluminium
sulfure de lithium
sulfure de calcium
nitrure de sodium
Les formules écrites ci dessus sont dites formules compactes ou formules brutes. Il existe une autre façon d'écrire les
formules, appelée formules développées ioniques :
Exemple :
Mg (colonne 2A) perd facilement 2 électrons , il devient alors ion Mg2+ . Cl (colonne 7A) capte facilement 1 électron,
il devient alors ion Cl- . Il faut donc 2 Cl- pour s'associer à Mg2+ pour former la molécule de formule développée
ionique ( Mg2+ ; 2 Cl- ) appelée chlorure de magnésium.
Sur le même modèle écrire les formules développées ioniques des corps suivants :
on écrit l'ion positif d'abord puis l'ion négatif.
chlorure de calcium
chlorure de sodium
chlorure d'aluminium
oxyde de magnésium
oxyde de sodium
oxyde d'aluminium
fluorure de potassium
bromure de baryum
iodure d'aluminium
sulfure de lithium
sulfure de calcium
nitrure de sodium

3- Modèle covalent simplifié (valable pour les colonnes A):
Ce modèle dit ceci :
Dans une molécule, les éléments des colonnes 1A et 7A font 1 liaison, ceux des colonnes 2A et 6A font 2 liaisons,
ceux des colonnes 3A et 5A font 3 liaisons et ceux de la colonne 4A font 4 liaisons.
Exemples :
O (colonne 6A) veut faire 2 liaisons et H (colonne 1A) veut faire 1 liaison H2O
formule développée formule brute
O (colonne 6A) veut faire 2 liaisons et C (colonne 4A) veut faire 4 liaisons CO2
Il peut y avoir de liaisons simples , doubles , ou triples
Sur le même modèle écrire les formules développées et brutes des corps suivants :
nom Formule développée Formule brute ou compacte
chlorure d'hydrogène
dihydrogène
dioxygène
diazote
dichlore
méthane (C et H avec que des
liaisons simples)
ammoniac (N et H avec que des
liaisons simples)
formaldéhyde ou formol( la plus
petite molécule avec C,H et O )
4- Exercice. Vous devez savoir ajuster une équation chimique. Dans cette exercice, remplacer tous les noms par les
formules compactes puis ajuster de telle sorte qu'il y ait autant d'éléments de chaque sorte de chaque côté de la
flèche.
Exemple : 2 H2 + O2 2 H2Oici il y a 4 H et 2O des 2 côtés de la flèche
le soufre réagit avec le lithium pour donner du sulfure de lithium
le dichlore réagit avec le métal sodium pour donner du chlorure de sodium
le dioxygène réagit avec le métal magnésium pour donner de l'oxyde de magnésium
le dihydrogène réagit avec le diazote pour donner de l'ammoniac
le méthane réagit avec le dioxygène pour donner du gaz carbonique et de l'eau
O H
H
OCO
1
/
2
100%