18/11/2013 MAIROT Kévin L3 Immunopathologie et

IMMUNOPATHOLOGIE ET IMMUNOINTERVENTION – Immunité anti-infectieuse
18/11/2013
MAIROT Kévin L3
Immunopathologie et immunointervention
Professeur Mege
10 pages
Immunité anti-infectieuse
A. Mécanismes de l'immunité infectieuse :
Nous sommes confronté en permanence à un grand nombre d'agents infectieux (AI).
La plupart sont des commensaux : loin d'être pathogènes, ils sont utiles au bon fonctionnement de notre
organisme.
Une minorité d'AI vont avoir des effets pathogènes, engendrant, une fois détecté, une réponse inflammatoire via
le système immunitaire. La combinaison de la réponse innée et adaptative permet :
–d'éliminer la très grande majorité des AI qui ont réussi à pénétrer l'organisme
–de créer une mémoire immunitaire de ce pathogène
Dans un tout petit nombre de cas, on fait une maladie infectieuse, pour deux raisons :
–l'agent infectieux est si efficace qu'il arrive à détourner la réponse immunitaire,
–ou la réponse immunitaire n'a pas été suffisamment efficace pour faire face à l'agression.
I. Les commensaux :
C'est l'ensemble des microbes que l'on trouve au niveau de la peau et des muqueuses. La plupart sont
incultivables, et les bactéries du tractus intestinal sont anaérobies.
On a pu étudier ces populations grâce aux techniques de séquençage à haut débits, qui ont mit en évidence une
compartimentalisation de celles-ci :
–au niveau de la peau, (follicules pileux, sébacés, et sudoripares) on retrouve des actinobactéries, des
firmucutes, des protéobactéries, représentant des millions de micro-organismes très divers.
–au niveau de la cavité orale (muqueuse bucale, salive, dents gencives) : on retrouve là aussi une
diversité au niveau de la flore avec des bacteriodetes, firmucutes, fusobactéries, proteobactéries
On retrouvera globalement les mêmes populations dans les intestins et les voies aériennes supérieures.
–au niveau du tractus intestinal : C'est dans le tube digestif que l'on trouve la plus grande quantité de
microbes, en particulier au niveau du colon, où l'on monte jusqu'à 1012 bactéries, avec essentiellement
des bacteoidetes et firmicutes.
On ne trouvera pas la même flore tout au long du tube digestif : au niveau du jéjunum et l'iléon on
trouve beaucoup moins de bactéries qu'au niveau du colon. Ainsi, ce qu'on mesure dans les selles n'est
qu'un reflet partiel de ce qu'on a dans le tube digestif.
1/10
Plan
A. Mécanismes de l'immunité infectieuse :
I. Les commensaux
II. Schéma général de la réponse immunitaire anti-infectieuse
III. Les pathogènes extracellulaires
IV. Les pathogènes intracellulaires
B. Exemples de maladies infectieuse :
I. Infection par le staphylocoque doré
II. La tuberculose
III. Hépatite B
IV. Hépatite C

IMMUNOPATHOLOGIE ET IMMUNOINTERVENTION – Immunité anti-infectieuse
–l'arbre respiratoire est colonisé surtout dans la partie supérieure, puisqu'il est quasi stérile au niveau
des l'alvéoles.
–On trouve essentiellement dans le tractus uro-génital des lactobaciles qui varient en fonction de la
grossesse, de l'activité sexuelle, du cycle menstruel...
•La flore intestinale :
On a longtemps pensé que le système immunitaire (SI) restait à distance des micro-organismes de la lumière
intestinale pour ne pas déclencher de réaction. En fait le SI est bien présent sous l'épithélium intestinal, il
reconnaît les bactéries de la flore, mais maintient l'état de réponse dans un état tolérant. Dans les maladies
inflammatoires des intestins (Crohn, rectocolite hémorragique, ...) cet état de tolérance est rompu.
Le rôle de la flore est de dégrader les aliments ingérés, mais aussi de former le système immunitaire, tant de
la muqueuse digestive, mais aussi systémique.
Ce rôle a été mit en évidence grâce à l'utilisation de souris « germ free », c'est à dire maintenues dans un état
stérile (et donc sans flore intestinale). On observe alors un défaut de développement du SI intestinal, au niveau
des CD4, CD8, T reg mais aussi pour certaines molécules anti-microbiennes.
L'absence de micro-organismes entraîne donc un déficit immunitaire.
A coté de ce modèle « caricatural », on a tout simplement l'antibiothérapie qui altère la flore intestinale,
modifiant la réponse immunitaire locale et amenant certaines pathologies (colites membraneuses... )
Un autre modèle de souris mime la colite inflammatoire. On s'est rendu compte qu'en administrant à ces souris
du polysaccharide A (PSA) produit par bacteroides fragilis (bactérie très représentée dans la flore intestinale
normale), on prévient la perte de poids, la formation de cytokines inflammatoires et le recrutement des cellules
inflammatoires.
L'effet protecteur est assuré par des CD4+ producteur d'IL-10 (cytokine anti-inflammatoire). Cette cytokine est
essentielle au maintient de l'homéostasie intestinale.
Les souries germ-free ont une expression réduite en IL-10. Si on leur inocule la bactérie qui produit le PSA, on
a une restitution d'IL-10.
La flore intestinale a donc un rôle régulateur de la réponse immunitaire intestinale.
On peut extrapoler ces conclusions au niveau de la peau et très probablement au niveau de l'arbre respiratoire.
Cette flore très dense nous protège aussi des pathogènes qui ont souvent un problème d'adaptation.
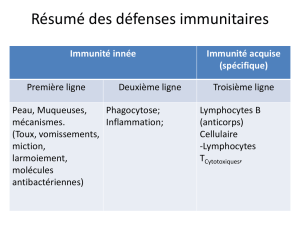
II. Schéma général de la réponse immunitaire anti-infectieuse :
La réponse immunitaire met du temps à se mettre en place, et on distingue plusieurs niveaux de réponse :
–immunité innée immédiate : elle est portée par la peau et les muqueuses parce qu'elle permet de
reconnaître l'agresseur de celui qui ne l'est pas et produit un certain nombre de médiateurs toxiques
capables de tuer l'agent infectieux.
2/10

IMMUNOPATHOLOGIE ET IMMUNOINTERVENTION – Immunité anti-infectieuse
–Réponse innée : elle intervient de 4 à 96h après le début de l'agression. Ce qui la caractérise est le
recrutement des cellules effectrices (PN, monocytes/macrophages, NK). Elles reconnaissent l'agent
infectieux, et libèrent des agents cytotoxiques.
–réponse adaptative : elle intervient après 96h (4 jours). Elle combine le recrutement d'effecteurs et la
reconnaissance par le SI des déterminants des agents infectieux : les cellules dendritiques présentent
l'AG aux LT → activation, et mise en place des effecteurs spécifiques ayant une mémoire immunitaire :
élimination de l'AI et protection pour une nouvelle rencontre. Il faut savoir que le système immunitaire
adaptatif ne permet pas, en particulier en cas d'agents infectieux intracellulaires, de complètement
éradiquer l'agent infectieux. Nous ne sommes donc pas à l’abri d'une récidive même si l'on a eu une
réponse immunitaire normale.
Schéma des étapes de la réponse immunitaire anti-infectieuse :
III. Les pathogènes extracellulaires :
Les pathogènes intracellulaires comprennent les bactéries et les helminthes.
Il peut y avoir des parasites qui ont des phases extracellulaires alors qu'ils sont globalement intracellulaires
(paludisme).
Voyons les moyens de luttes du SI contre les pathogènes extracellulaires :
–complément,
–anticorps,
–phagocytes (polynucléaires, monocytes/macrophages),
–cytokines.
a) Le complément :
Le système du complément est une activation en cascade de molécules débouchant sur des lésions à l'intérieur
des cellules.
La cascade, présente parmi les premières minutes de défense, a un rôle d'inflammation, ou d'opsonisation ou
plus rarement un rôle cytotoxique.
3/10

IMMUNOPATHOLOGIE ET IMMUNOINTERVENTION – Immunité anti-infectieuse
Exemple d'altérations de la voie du complément :
–Altération de la voie classique : La voie classique est engendrée par les complexes Ag-Ac, et n'est
donc pas la première mise en jeu, étant donné que s'il y a déjà les anticorps présents, c'est que
l'immunité adaptative est déjà en place et que l'infection a quelques jours.
Le déficit en C2 et se traduit par des infections bactériennes ou des maladies auto-immunes.
–Altération de la voie des lectines : La voie des lectines est l'équivalent de la voie classique, l'initiation
est différente : une lectine se fixe à la surface du pathogène activant deux protéases qui activent C2 et
C4, rejoignant ainsi la voie classique.
Son altération se traduit par des infections graves et récurrentes aux bactéries extracellulaires
–Déficits en C3 : C'est une molécule carrefour aux voies d'activations du complément.
Son déficit entraîne des infections à bactéries extracellulaires (encapsulées), mais aussi des maladies
auto-immunes.
–Déficits de la voie alterne : Ils engendrent également des infections à bactéries extracellulaires et des
maladies auto-immunes.
–Déficit du complexe d'attaque membranaire : Il se traduit par un tableau clinique particulier :
infections récurrentes, systémiques avec des germes de la famille nesseria amenant des méningites à
répétition qui arrivent essentiellement chez l'enfant de 5-10 ans. Face à ce type de tableau on doit penser
à un déficit du complexe d'attaque membranaire.
Donc le complément est une voie essentielle dans la lutte contre les bactéries extracellulaires
4/10

IMMUNOPATHOLOGIE ET IMMUNOINTERVENTION – Immunité anti-infectieuse
b) Les anticorps :
Dans la défense anti infectieuse, les anticorps ont trois fonctions :
–neutralisation : c'est une fonction essentielle dans la lutte antivirale. Le virus est protégé tant qu'il reste
dans la cellule, par contre il est exposé aux anticorps lorsqu'il quitte une cellule pour en contaminer une
autre.
–activation du complément
–opsonisation : elle est la plus importante quantitativement. Les AI vont être reconnus par des Ac
spécifiques qui vont se fixer aux récepteurs Fc des PNN, PNE, monocytes macrophages qui
phagocyteront le complexe Ag-Ac.
c) Les polynucléaires (PN) :
Les PN sont très nombreux et éliminent les agents infectieux de plusieurs façons :
–Phagocytose via opsonisation : les bactéries recouvertes par du complément ou des Ig vont être
phagocyté par les PN et y être dégradés.
–Production de dérivés de l'oxygène (ROS) qui vont jouer un rôle protecteur important (spécialité des
PN ; les monocyte/macrophages en produisent aussi mais à un degré moindre)
–Les granules vont exercer un pouvoir de lutte microbicide
–Les NET (Neutrophil Extracellular Trap) : ce sont des « commettes d'ADN » qui sont relarguées par les
PN qui vont accrocher comme une glu les micro-organismes présents aux alentours. Cet ADN contient
des enzymes, surtout de l'elastase (une protéase).
Les PN sont donc capables de tuer les agents infectieux extracellulaires via les NET, et les intracellulaires via la
phagocytose.
Le déficit en PN se traduit par des infections :
–Neutropénie : elle peut être soit congénitale, soit secondaire à une chimiothérapie. Elle entraîne des
infections bactériennes pyogènes (extracellulaires) avec fièvre, ulcères des muqueuses...
–Granulomatose septique : elle se traduit par un défaut de production des ROS. De ce fait les
polynucléaires sont déficients, engendrant une susceptibilité accrue aux infections bactériennes
extracellulaires (idem neutropénie), mais pas seulement : la production des ROS n'étant pas
exclusivement assurée par les PN, le déficit touche d'autres types cellulaires entraînant des infections
par des bactéries intracellulaires.
–La réponse des PNN dépend des lymphocytes Th17. Le déficit en lymphocytes Th17 se traduit donc
par une plus grande susceptibilité aux bactéries extracellulaires, mais aussi à certains champignons.
–Pathologies des granules.
–Pathologies du chimiotactisme.
–Déficits en molécules d'adhésion.
d) Les monocytes / macrophages :
Les monocytes circulants sont recrutés dans les tissus où ils vont exercer soit suite à une stimulation directe par
l'agent infectieux, soit via les Ac, une action cytotoxique en produisant :
–des médiateurs cytotoxiques,
–des ROS (moins que les PNN) ,
–des dérivés actifs de l'azote,
–une fusion phagosome lysosome (mécanisme le plus important des monocytes macrophages)
–production de peptides antimicrobiens,
–une régulation fer/nutriment. Les surcharges en fer se traduisent par une plus grande susceptibilité aux
infections.
5/10
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%