Trajet de la douleur

UE 5 – Physiologie – Chapitre 3 17.09.2012
1/11
Physiologie de la Douleur
I. Introduction
A. Définition
- La douleur est une expérience sensorielle et émotionnelle désagréable (donc consciente) liée à une lésion tissulaire réelle ou
possible ou décrite en référence à une telle lésion.
« En référence à une telle lésion » douleur psychogène.
3 dimensions décrites par Melzack :
o Dimension cognitivo-évaluative : possibilité d’évaluer une même douleur de manière différente selon que son attention est
attirée sur la douleur ou au contraire discrète.
o Dans une expérience le seuil douloureux est abaissé si on prévient de la douleur (donc douleur apparait plus tôt pour
des stimulations croissantes). Inversement le seuil douloureux est augmenté si on le fait exercer un effort intellectuel en
même temps.
o Dimension sensori-discriminative : à partir de quand la douleur est douloureuse ? La localisation ? L’intensité ? Qualitative
(piqure, brûlure, etc.) ?
o Dimension affectivo-motivationnelle : dimension importante dans les douleurs chroniques où la douleur peut aboutir à des
perturbations de l’humeur et engendrer des états dépressifs.
B. Fonctions de la douleur
- Rôle de la douleur aigue : protection (signal d’alarme).
Application pathologique : certains patients ont une insensibilité congénitale à la douleur (extrêmement rare), sujet
dépourvus de petites fibres sensitives. Ces sujets développent des tas de lésions cutanés très importantes (nécroses,
amputations, etc.) car ils ne possèdent plus de signal d’alarme.
C. Types de douleurs chroniques
La douleur chronique (douleur > 3 mois) correspond notamment au syndrome douloureux chronique.
Le SN est très plastique, il se transforme selon l’expérience. Les gens qui ont une douleur chronique ont un système de douleur
différent.
- Douleurs d’origine nociceptive : douleur physiologique
ex : rage de dents
- Douleurs neurogènes : douleurs qui sont dus à une lésion du système nerveux. Ce sont des douleurs spontanées qui arrivent
en l’absence de stimulation nociceptives. Il en existe deux types :
o Par atteinte du SN périphérique, telle que dans les neuropathies (exemple : diabétique), dans les lésions
traumatiques (exemple : déafférentation d’un nerf).
o Par atteinte du SN central : lésions principalement au niveau des noyaux thalamiques à l’origine de douleurs
intenses appelées causalgies.
Ex : douleur sans raison à l’abdomen
- Douleurs psychogènes : douleurs dus à un processus de somatisation du vécu psychique, traitées par les psychologues et
n’intéressent pas la physiologie (souvent chez les patients dépressifs)

Document1
2/11
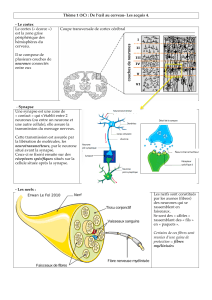
II. Trajet de la douleur (périphérie cortex)
A. Etape périphérique
- Tout ce qui se passe entre la lésion tissulaire et la stimulation des nocicepteurs.
- Les nocicepteurs sont des terminaisons nerveuses libres soit :
o D’afférences cutanées : fibres δ (myélinisées) de Ø < 5µm ou fibres C (amyéliniques).
o D’afférences musculaires : fibres du groupe III et IV.
- Activation des nocicepteurs :
o Directe : mécanique, thermique, chimique.
o Indirecte :
o Par des substances algogènes.
o Par des substances qui sensibilisent les récepteurs aux substances algogènes (substances libérées par le
tissu lésé : plaquettes, polynucléaires, lymphocytes, macrophages et monocytes).
- Une lésion tissulaire crée un processus inflammatoire. Ce processus inflammatoire favorise :
o La vasodilatation des vaisseaux.
o L’extravasation (↑de la perméabilité capillaire) : permet aux cellules circulantes de sortir dans les tissus. Arrivées
dans les tissus de : macrophage, polynucléaire, plaquettes, mastocytes.
Le processus inflammatoire entretient la douleur. Au bout d’un certain temps, la douleur n’est plus liée au traumatisme
initial mais seulement à l‘inflammation.
- Libération par ces cellules de différentes substances pro-inflammatoires :
o Les cytokines (libérées par les macrophages) qui agissent sur les fibroblastes pour la production de
prostaglandines. Les prostaglandines ont une action d’excitation des nocicepteurs.
o La bradykinine est une substance très algogène.
o La sérotonine 5-HT (libérée par les plaquettes) est une substance algogène.

Document1
3/11
o L’histamine (libérée par les mastocytes) est une substance qui peut être algogène.
o Il existe d’autres substances qui ne sont pas directement algogènes (telle que le NGF) mais qui sont des facteurs de
transcription qui favorisent la synthèse de molécules qui sensibilisent le nocicepteur.
- La terminaison nerveuse libre (nocicepteur) a deux rôles :
o création de potentiels d’action à l’origine de la douleur
o Il se crée une inflammation neurogène : Les terminaisons nerveuses vont libérer des substances telles que
substance P (neuropeptide), CGRP (neuropeptide), NO.
Ces trois substances entretiennent le mécanisme inflammatoire (favorise vasodilatation et extravasation).
= « cercle vicieux »
- Les fibres nerveuses du SN orthosympathique peuvent être stimulées et participer à l’excitation des nocicepteurs -> Leur
stimulation chronique est à l’origine des algo-neuro-dystrophies).
- Les antalgiques sont de 2 types :
o Agissent au niveau du SNC sur les récepteurs morphiniques.
o Agissent au niveau du SNP. Ce sont souvent des médicaments antalgiques et anti-inflammatoires.
Ex: L’aspirine est un inhibiteur de synthèse des prostaglandines (substances pro-inflammatoires)
-> elle diminue l’inflammation donc la douleur (effet antalgique) mais n’a aucune action sur le Système Nerveux !
-> Tous les anti-inflammatoires sont antalgiques
- Stimulation des nocicepteurs nerf :
remonte par la corne postérieure de la moelle épinière se projette au niveau des cellules de la corne grise
postérieure de la moelle épinière via 2 neuromédiateurs : glutamate (excitateur) + substance P (neuropeptide).
Glutamate et Substance P sont les 2 neuromédiateurs de la douleur
et sont libérés en même temps.
o collatérales qui agissent sur :
o Mastocytes : libération histamine.
o Plaquettes : libération de substance P et sérotonine.
o Capillaires : libération bradykinine.

Document1
4/11
B. Projections médullaires
- Au niveau de la corne grise postérieure.
- Les grosses fibres qui transportent le tact (Aα et Aβ) :
o Remontent par la voie lemniscale.
o Collatérales qui vont dans les couches IV et V de Rexed (à l’origine du faisceau spino-thalamique).
- Les petites fibres qui transportent la douleur (Aδ) vont dans les couches I et II (et accessoirement V) de Rexed.
- Application clinique : cette séparation nette des petites et des grosses fibres permet de faire des radicotomies sélective des
petites fibres chez des personnes ayant des algies de zona.
Expérience chez le singe :
- Etude des neurones de la couche V : 2 types de cellules
o Neurones nociceptifs spécifique : neurones activés que par des stimulations nociceptives (petites fibres)
o Neurones convergents : par les petites et grosses fibres.
- On enregistre les potentiels de ces deux types de fibres nerveuses.
- Stimulations des neurones nociceptifs spécifiques :
o Mouvement de poils pas d’activation.
o Pression pas d’activation.
o Pincement pas d’activation.
o Pincement intense activation.
Ces neurones ne s’activent que par une stimulation douloureuse.
- Stimulations des neurones convergents :
o Mouvement de poils activation.
o Pression activation.
o Pincement activation.
o Pincement intense activation plus forte.
Ces neurones s’activent pour une stimulation douloureuse et pour une stimulation mécanique.
Expérience sur le singe

Document1
5/11
C. Voies ascendantes
a) Faisceau néo-spinothalamique
- Relais dans la corne antérieure de substance grise de la moelle épinière.
- Relais dans noyau postéro-ventro-latéral du thalamus.
- Pour le N. trijumeau V :
o Les fibres nociceptives rentrent au niveau de la protubérance.
o Descendent pour faire relais dans la partie descendante du noyau du V.
o Relais dans le noyau trijuminal.
o Remontent.
b) Faisceau paléo-thalammmique
- 1er relais : corne antérieure de la substance grise de la moelle épinière.
- Decussation.
- 2ème relais : noyau intralaminaires du thalamus.
- Mais envois des collatérales pour faire des projections :
o Au niveau de la réticulée.
o Au niveau du bulbe.
o Au niveau de l’amygdale (structure dans le lobe temporal, impliqué dans la physiologie des émotions).
Des informations douloureuses montent et projettent sur l’amygdale pour générer des émotions, sans pour autant projeter
sur le cortex sensitif (information douloureuse peut générer des émotions sans qu’on soit conscient de la douleur).
o Au niveau de l’insula.
o Au niveau du cortex cingulaire.
o Au niveau de l’hypothalamus : stimulation de l’axe corticotrope. Douleur à l’origine d’une libération de cortisone et
de noradrénaline.
- Ces projections sont impliquées dans les signes neuro-végétatifs qui accompagnent une stimulation douloureuse.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%