TD_chapitre_18_Redox..

!"#$%&'()*+),)-./01'2034&%15)(5)4"%6%()1'7#5%83()))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))9(:;<'()=>*?@=>*A)
)
*)
BC)!DEFGBHI)*+),)-JKC-HLCM!BG-N)IN)!DGOGI)-HPENGQMI)
!
Ce!qu’il!faut!savoir!:!
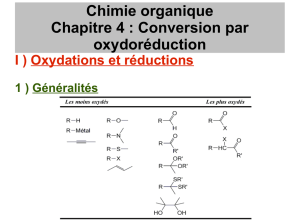
N%<(#3)0R1./0#&%15)0(S)7'13$(S)4#'#4&2'%S&%83(S)T5U1U)03)4#'V15():154&%155(WX)
F'103%&S)$1SS%VW(S)W1'S)0()0R1./0#&%15)0(S)#W411WS)S(W15)W(3')4W#SS(U)
-V&(5&%15)0R35)0%1W)syn)Y)$#'&%')0R35)#W4;5()$#')#4&%15)4#&#W/&%83()0()-S-?)(5)$'2S(54()0R35)411./0#5&)T4150%&%15S)1$2'#&1%'(SZ)
S2W24&%<%&2X)
-./0#&%15)0()9(6%(3.@[15"S15)T$'%54%$()(&)4150%&%15S)1$2'#&1%'(SXU)
H2034&%15) 0(S) 416$1S2S) 4#'V15/W2S) (5) #W411W) $#') #4&%15) 03) &2&'#"/0'3'1V1'#&() 0()S10%36) T4150%&%15S) 1$2'#&1%'(S) (&)
624#5%S6(X)
)
Ce!qu’il!faut!savoir!faire!:!
G0(5&%:%(')35)$'14(SS3S)0R1./0#&%15)13)0()'2034&%15Z)(&)/)#SS14%(')W#)0(6%@283#&%15)'(01.)41''(S$150#5&(U)
C2&('6%5(') W(S) $'103%&S) 0R1./0#&%15) 0R35) #W411W) (5) #5#W/S#5&) S#) 4W#SS(Z) W(S) 01552(S) (.$2'%6(5&#W(S) (&\13) 0(S) #5#W/S(S)
S$(4&'1S41$%83(SU)
H($'2S(5&(')35)4/4W()4#&#W/&%83(Z)%0(5&%:%(')35)4#&#W/S(3')0#5S)35)4/4W(U)
!166(5&(')W#)4"%6%1S2W(4&%<%&2)0R35()'2#4&%15)(5)#5#W/S#5&)W(S)$'103%&S)1V&(53SU)
)
Savoir'appliquer'le'cours…'
Exercice!1!:!Vrai!ou!faux!?!
*U 9()$'1$#5@*@1W)(S&)1./02)(5)$'1$#5#W)(5)$'2S(54()0()&'%1./0()0()4"'16()(5)6%W%(3)#4%0()#83(3.U)
=U 9()$'1$#5@*@1W)(S&)1./02)(5)#4%0()$'1$#51]83()(5)$'2S(54()0()&'%1./0()0()4"'16()0#5S)W#)$/'%0%5()#5"/0'(U)
^U 9()=@62&"/W$'1$#5@=@1W)5R(S&)$#S)1./02)(5)$'2S(54()0()0%4"'16#&()0()$1&#SS%36)(5)6%W%(3)#4%0()#83(3.U)
?U I5)$'2S(54()0()&2&'#1./0()0R1S6%36)(&)0()$('%10#&()0()S10%36Z)35)#W4;5()(S&)1./02)(5)0%1WU)
AU 9#)'2#4&%15)0()WR14&@^@;5()#<(4)35()83#5&%&2)4#&#W/&%83()0()&2&'#1./0()0R1S6%36)(&)35()83#5&%&2)S&_4"%162&'%83()0()
411./0#5&)"(.#4/#51:(''#&()(5)6%W%(3)#83(3.)0155('#)WR14#(@^Z?@0%1WU)
`U M5()42&15()6%S()(5)$'2S(54()0()N#aD?)$(3&)b&'()&'#5S:1'62()(5)#W411W)$#')1./0#&%15U)
cU d%) W() ?@"/0'1./62&"/W4/4W1"(.#51W) (S&) 1./02) $#') WR%15) 0%4"'16#&() $13') :1'6(') W() 416$1S2) eEfZ) 015&) W() S$(4&'()
%5:'#'137()416$1'&()35()V#50()W#'7()<('S)^^>>)46@*Z)(&)0(3.)V#50(S):%5(S)(&)%5&(5S(S)(5&'()*c>>)(&)*cA>)46@*Z)4R(S&)
83()W#)'2#4&%15)#)(3)W%(3)(5)6%W%(3)#83(3.U))
!
Exercice!2!:!Identifier!des!réactifs!ou!des!produits!
*U G0(5&%:%(') W(S) '2#4&%:S) #XZ) VXZ) 4X) (&) 0X) $('6(&&) 0R1V&(5%') W(S)
$'103%&S)S3%<#5&SU)
)
=U G0(5&%:%(')W(S)$'103%&S)EZ)aZ)!Z)C))(&)I)T15)$'24%S('#)W()
S&2'210(S4'%$&(3')0(S)4#'V15(S)#S/62&'%83(SX)
)
)
Exercice!3!:!Réduction!d’une!cétone!
-5)$W#4()W#)?Z?@0%62&"/W$(5@=@15()(5)$'2S(54()0()&2&'#V1'1"/0'3'()0()S10%36)0#5S)WR2&"#51WU)
*U C155(') W() T13) W(SX) $'103%&TSX) 1V&(53TSXZ) (5) $'24%S#5&) W#) S&2'214"%6%() T(&) W(S) $'1$1'&%15S) S%) $W3S%(3'S) $'103%&S) S15&)
1V&(53SXU))
=U O15&'(')83R%W)SR#7%&)V%(5)0R35()'2034&%15U)
^U C155(')W()624#5%S6()0()W#)'2#4&%15U))
?U Q3(WW()83#5&%&2)0()&2&'#V1'1"/0'3'()0()S10%36)(S&)524(SS#%'()g)
AU !166(5&(')W#)S&2'21S2W(4&%<%&2)13)515)0()W#)'2#4&%15U)
!
OOH
+ énantiomère
O
OH
OH + énantiomère
OO
O
a)
b)
c)
d)
OH
A
B
C
D +
O
H
H
E
K2Cr2O7 (aq)
H2SO4
CrO3
pyridine
OsO4 (cat)
H2O2
OsO4 (cat)
NaIO4 (excès)
NaIO4
NaBH4

!"#$%&'()*+),)-./01'2034&%15)(5)4"%6%()1'7#5%83()))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))9(:;<'()=>*?@=>*A)
)
=)
Exercice!4!:!Oxydation!des!alcools!
-5)0%S$1S()0()&'1%S)V13&(%WW(S)0R#W411WS)%S16;'(SZ)&13&(S)2&%83(&2(S)#<(4)W#):1'63W()V'3&()!?D*>-U)C#5S)&'1%S)&3V(S)Y)(SS#%S)B*Z)B=)
(&)B^Z)15)S136(&)35)24"#5&%WW15)0()4(S)&'1%S)#W411WS)Y)WR#4&%15)0R35()S1W3&%15)#83(3S()0()0%4"'16#&()0()$1&#SS%36)(5)(.4;S)(&)(5)
$'2S(54()0R#4%0()S3W:3'%83(Z)Y)&(6$2'#&3'()#6V%#5&(U)9()&3V()^)5():#%&)$#S)#$$#'#h&'()W#)413W(3')<('&()4#'#4&2'%S&%83()0(S)%15S)
415&'#%'(6(5&)#3.)0(3.)#3&'(S)&3V(SU)-5)0155()W(S)S$(4&'(S)GH)0(S)416$1S2S)1V&(53S)#$';S)'2#4&%15U))
*X I4'%'()W#)0(6%@283#&%15)03)413$W()0R1./01@'2034&%15)!'=-c=@\!'^iU)
=X C155(')W()516)(&)W#):1'63W()&1$1W17%83()0()WR#W411W)$W#42)0#5S)W()&3V()=)(5)j3S&%:%#5&U)I4'%'()WR283#&%15)0()W#)'2#4&%15)83%)
SR(S&)$'103%&(U))
^X C155(')W()516)(&)W#):1'63W()&1$1W17%83()0()WR#W411W)$W#42)0#5S)W()&3V()^)(5)j3S&%:%#5&U)
?X Q3(WS)S15&)W(S)0(3.)#W411WS)$1SS%VW(S)415&(53S)0#5S)W()&3V()*)g)-5)0155()W()S$(4&'()HON)03)$'1&15)0()WR#W411W)415&(53)0#5S)
W()&3V()*U)!154W3'()(&)0155(')WR283#&%15)0()W#)'2#4&%15)83%)SR(S&)$'103%&(U))
''
'''Spectre'IR'du'tube'1'après'réaction'
)
'
'''Spectre'IR'du'tube'2'après'réaction'
'
''
'''Spectre'IR'du'tube'3'après'réaction'
Spectre'RMN'du'tube'1'avant'réaction'
)

!"#$%&'()*+),)-./01'2034&%15)(5)4"%6%()1'7#5%83()))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))9(:;<'()=>*?@=>*A)
)
^)
Exercice!5!:!Syndihydroxylation!
*X H($'2S(5&(')W(S)$'103%&S)0(S)'2#4&%15S)S3%<#5&(S)(5)$'24%S#5&)W(S)S&2'210(S4'%$&(3'S)0(S)4#'V15(S)#S/62&'%83(S),))
)
#U )
)
VU )
)
=X C#5S) W() 4#S) 0() W#) '2#4&%15) VU) 4%@0(SS3SZ) '($'2S(5&(') W() 4/4W() 4#&#W/&%83() 41''(S$150#5&) T15) $'24%S() 83() D=-=)(S&)
WR1./0#5&)03)413$W()D=-=\D=-XU)I4'%'()W()V%W#5)0()W#)'2#4&%15U))
)
^X H($'2S(5&(') W(S) S3VS&'#&S) 83%) 15&) 41503%&) #3.) $'103%&S) S3%<#5&SZ) (5) $'24%S#5&) W(S) S&2'210(S4'%$&(3'S) 0(S) 013VW(S)
W%#%S15S),)
#U ! !
!
VU !
!
!
Exercice!6!:!Oxydation!de!Lemieux!HJohnson!
*X))C155(')W()TW(SX)$'103%&TSX)0(S)'2#4&%15S)S3%<#5&(S),))
#X))
)
VX))
)
4X))
)
)
=X)C155(')W(S)02'%<2S)2&"/W25%83(S)83%)41503%S(5&)#3.)$'103%&S)S3%<#5&S)#$';S)35()1./0#&%15)0()9(6%(3.@[1"5S15),)))
*X *)61W()0()V3ȃ()(&)*)61W()0R2&"#5#W)
=X =)61W()0()$'1$#515()
^X D(.#50%#W)35%83(6(5&)TW#)&('6%5#%S15)al)02S%75()W#):154&%15)#W02"/0(XU)
?X *)61W()0()?@1.1$(5#W)Toxo)02S%75()35():154&%15)42&15()W1'S83R(WW()5R(S&)$#S):154&%15)$'%54%$#W()0#5S)W#)61W243W(XU))
AX *)61W()0()!/4W1024#5(@*Z`@0%15()35%83(6(5&)T4%@0(SS13SX)
O
O
)
^X)-5)415S%0;'()W(S)&'1%S)#W4;5(S)S3%<#5&S),))
))
)
#U 91'S83() 4(S) &'1%S) #W4;5(S) S15&) S136%S) #3) 62W#57() -S-?\N#G-?Z) S(3W) W() 02'%<2) 2&"/W25%83() eEf) 0155() 0(3.) $'103%&SU)
G0(5&%:%(')eEf)(&)0155(')W#)S&'34&3'()0(S)0(3.)$'103%&SU)
VU d136%S)#3)62W#57()-S-?\D=-=Z)eaf):1'6()W(S)416$1S2S)eCf)(&)eCRf)#W1'S)83()e!f):1'6()35)35%83()416$1S2)eIfU)C155(')
W(S)S&'34&3'(S)0()eCfZ)eCRf)(&)eIf)(&)%0(5&%:%(')eaf)(&)e!fU)Q3(WW()(S&)W#)'(W#&%15)(5&'()eCf)(&)eCRf)g)
!
MeOOC COOMe
H
Ph OsO4
H2O
OsO4 (cat)
H2O2
OH
OH
OsO4
H2O
OH
HO CH3
H
H3C
H+ énantiomère
OsO4
H2O
myrcène
OSO4
NaIO4
1-méthylcyclopentène OSO4
NaIO4
limonène
OSO4
NaIO4

!"#$%&'()*+),)-./01'2034&%15)(5)4"%6%()1'7#5%83()))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))9(:;<'()=>*?@=>*A)
)
?)
Exercice!7!:!Réductions!
9() =@1.1@^Z^@0%62&"/WV3(0%1#&()0()0%2&"/W() eEf) '2#7%&) #<(4) >ZA) 283%<#W(5&) 61W#%'() 0() N#aD?)$13') 0155(') W() 416$1S2) eaf)
015&)W()S$(4&'()GH)$'2S(5&()35()V#50()2&'1%&()(&)%5&(5S()Y)*c^*)46@*)(&)35()V#50()W#'7()Y)^?+>)46@*U)
[A]
O O
O
O
O
)
*X C155(')W#)S&'34&3'()0()eafU)
=X N#aD?)(S&@%W)(5)(.4;SZ)(5)02:#3&)13)(5)$'1$1'&%15S)S&_4"%162&'%83(S)#<(4)eEf)g)
d136%S)Y)9%EWD?)$3%S)Y)35()"/0'1W/S(Z)W()416$1S2)eEf)0155()e!f)0():1'63W()V'3&()!`D*?-^)015&)W()S$(4&'()GH)5()$'2S(5&()#3435)
S%75#W)(5&'()*`A>)(&)*+>>)46@*U)
^X C155(')W#)S&'34&3'()0()e!fU)
?X d136%S)Y)!'-^Z)e!f)0155()eCf)(5)6%W%(3)#4%0()#83(3.)(&)eIf)0#5S)W#)$/'%0%5()#5"/0'(U)C155(')W(S)S&'34&3'(S)0()eCf)(&)eIfU)
AX C155(')W(S)283#&%15S@V%W#5)0(S)&'#5S:1'6#&%15S)0()e!f)(5)eCf)(&)eIfU)
!
A!rendre!:!Exercice!8!:!Clivage!oxydant!d’un!alcène!
9()&'#%&(6(5&)0R35)#W4;5()E)$#')W()$2'%10#&()0()S10%36)N#G-?)(5)$'2S(54()0()&2&'#1./0()0R1S6%36)0155()0(3.)416$1S2S)a)T0()
:1'63W()!?D+-X)(&)!)T0():1'63W()!^D`-X)015&)W(S)S$(4&'(S)HON)S15&)01552S)4%@415&'(U)
*X E5#W/S(')4"#435)0(S)$%4S)(&)02&('6%5(')W#):1'63W()(&)W#)S&'34&3'()0()a)(&)!U)
=X I5)0203%'()W(S):1'63W(S)$1SS%VW(S)0()EU)
^X d#4"#5&)83()W()&'#%&(6(5&)0()E)$#')0()WR(#3)1./7252()(5)$'2S(54()0()-S-?)0155()35)62W#57()'#426%83()0()0%1W)C)
S13S):1'6()0R35)413$W()0R25#5&%16;'(S)THZdX)k)TdZHXZ)$'24%S(')EU)
?X -5)'2#W%S()W(S)S$(4&'()%5:'#'137(S)0(S)416$1S2S)E)(&)CU)Q3(WW(S)0%::2'(54(S)(SS(5&%(WW(S)$'2S(5&(5&)4(S)0(3.)S$(4&'(S)g)
)
)
))
)
)
)
'
'
Données':'
!
)
012345678910111213
δ (ppm)
H
H
H
O
O
H
H
O
N
H
O
H
NH
HO
O
H
O
H
1
/
4
100%