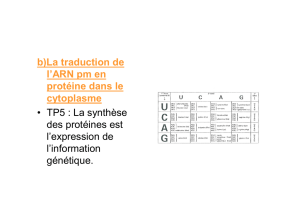
Régulation post-transcriptionnelle de l`expression des gènes du

Journal Identification = VIR Article Identification = 0483 Date: April 4, 2013 Time: 3:4 pm
revue
Virologie 2013, 17 (2) :96-110
Régulation post-transcriptionnelle de l’expression
des gènes du cycle productif des herpesvirus :
rôle de la protéine EB2 du virus d’Epstein-Barr
et de ses analogues
Franceline Juillard1,2,3,4,5
Fabrice Mure1,2,3,4,5
Quentin Bazot1,2,3,4,5
Évelyne Manet1,2,3,4,5
Henri Gruffat1,2,3,4,5
1CIRI,
International Center for Infectiology
Research,
Université de Lyon,
Lyon,
France
2Inserm,
U1111,
Lyon,
France
3École normale supérieure de Lyon,
Lyon,
France
4Université Lyon-I,
Centre international de recherche en
infectiologie,
Lyon,
France
5CNRS,
UMR5308,
Lyon,
France
Résumé. Le niveau d’expression des ARNm lors d’une infection virale produc-
tive n’est pas uniquement le reflet du taux de transcription des gènes viraux. La
stabilité des ARNm viraux et l’efficacité de leur export nucléocytoplasmique sont
aussi très importants pour une expression optimale des gènes lors du cycle viral
productif. Il est maintenant bien établi que tous les herpesvirus expriment un fac-
teur nécessaire à l’accumulation cytoplasmique d’ARNm viraux issus de gènes
dépourvus d’intron. Cette famille de protéines comprend le facteur EB2 du virus
d’Epstein-Barr (EBV) et ses analogues : la protéine ICP27 d’HSV, la protéine
UL69 du cytomégalovirus (CMV), la protéine ORF57 du virus de la maladie
de Kaposi (KSHV) ou encore la protéine IE4 du virus Varicelle Zona (VZV).
Ces protéines sont capables de stabiliser leurs ARNm cibles dans le noyau et en
interagissant avec divers facteurs cellulaires comme les protéines TAP/NXF1,
SR, RBM15, de favoriser l’accumulation de ces ARNm dans le cytoplasme
où elles stimulent leur traduction en protéines. La compréhension des méca-
nismes d’action de ces facteurs multifonctionnels est un enjeu important pour les
recherches d’antiviraux spécifiques.
Mots clés : herpesvirus, cycle productif, régulation post-transcriptionnelle,
ARNm export
Abstract. During viral infection, the amount of viral mRNAs expressed is not
only a reflection of the viral gene transcription level: mRNA stability and nucleo-
cytoplasmic export are also important for optimal viral gene expression during
the productive cycle. It is now well established that herpesviruses express a pro-
tein absolutely required for the cytoplasmic accumulation of some viral mRNAs
transcribed from intronless genes. This family of proteins comprises the EB2 fac-
tor from Epstein-Barr virus (EBV), and its similar proteins: ICP27 from HSV-1,
UL69 from cytomegalovirus (CMV), ORF57 from KSHV and IE4 from VZV.
These proteins are able to stabilize their target mRNAs in the nucleus and, by
interacting with various cellular factors (TAP/NXF1, SR proteins, RBM15 etc),
promote mRNA export to the cytoplasm, where they are also involved in the trans-
lation efficiency of these viral mRNAs. On the basis of their essential role in the
viral productive cycle, these multifunctional viral factors should be considered
as important targets for therapeutic approaches.
Key words: herpesvirus, productive cycle, post-transcriptional regulation,
mRNA export
Tirés à part : H. Gruffat
96 Virologie, Vol 17, n◦2, mars-avril 2013
doi:10.1684/vir.2013.0483
Pour citer cet article : Juillard F, Mure F, Bazot Q, Manet ´
E, Gruffat H. Régulation post-transcriptionnelle de l’expression des gènes du cycle productif des herpesvirus : rôle de la protéine EB2 du
virus d’Epstein-Barr et de ses analogues. Virologie 2013; 17(2) : 96-110 doi:10.1684/vir.2013.0483
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 26/05/2017.

Journal Identification = VIR Article Identification = 0483 Date: April 4, 2013 Time: 3:4 pm
revue
Introduction
Le génome cellulaire a la particularité d’être extrêmement
morcelé. La très grande majorité des gènes, principalement
ceux codant des protéines mais aussi certains gènes non
codants comme ceux des ARNt, est constituée d’une suite
alternée d’exons et d’introns dont la taille et le nombre
peuvent être très variables. Au cours de la transcription
des gènes codant des protéines, un pré-ARNm est syn-
thétisé et est simultanément coiffé, épissé (élimination des
introns) et polyadénylé dans le noyau de la cellule pour
donner lieu à l’ARNm dit mature. Cet ARNm mature,
constitué des seuls exons, est alors exporté vers le cyto-
plasme pour être traduit en protéine. La translocation de
l’ARNm mature à travers le pore nucléaire nécessite la
présence sur l’ARNm d’un hétérodimère composé des pro-
téines TAP (aussi appelée NXF1) et p15 (aussi appelée
NXT1). L’hétérodimère TAP/p15 permet le passage de
l’ARNm à travers le pore nucléaire en interagissant directe-
ment avec les nucléoporines qui le composent. Cependant,
pol
pol pol
hTHO
UAP56
REF
hTHO
UAP56
REF
EJC
EJC
AAAAA
PABP
PABP
AAAAA
Initiation Élongation
Transcrition
Maturation de l’ARN
Coupure/Polyadénylation Export
Noyau Cytoplasme
hTREX
hTREX
hTREX
SR
SR
TREX
EJC
Complexe de coupure/
polyadénylation
Complexe
d’épisage
REF
TAP
TAP
TAP
SR
hTREX
Figure 1. Représentation schématique de l’export des ARNm issus de gènes avec introns. Dès le début de la transcription par l’ARN
polymérase II, le complexe hTREX est recruté en 5de l’ARNm. Le complexe TREX est composé des protéines REF et UAP56 associées
au complexe hTHO, il est recruté sur l’ARNm grâce à l’interaction des protéines REF et UAP56 avec le complexe protéique interagissant
avec la coiffe (CBC). Au cours de l’élongation, le complexe d’épissage, qui est composé de nombreuses protéines dont des protéines SR,
supprime l’intron. Il subsiste au niveau de la jonction des deux exons un complexe nommé EJC (pour complexe de la jonction exon-exon).
Lorsque l’ARN polymérase rencontre un signal de coupure-polyadénylation, l’ARNm est coupé et polyadénylé. Puis le facteur d’export TAP
est recruté sur l’ARNm, grâce notamment à certaines protéines SR et à la protéine REF. Ce facteur TAP permet le franchissement du pore
nucléaire en interagissant directement avec certaines nucléoporines. Ce franchissement est probablement polarisé grâce à la présence
du complexe hTREX en 5de l’ARNm. Puis dans le cytoplasme, l’ARNm exporté est traduit en protéine.
TAP/p15 ne présente que peu d’affinité pour l’ARNm
et son recrutement est dépendant d’autres facteurs cellu-
laires, comme le facteur REF/Aly ou les protéines SR,
qui sont recrutés plus précocement sur l’ARNm, en par-
ticulier au cours de l’étape d’épissage des introns. Lors
de cette étape d’épissage, deux complexes multiprotéiques
sont ajoutés sur l’ARNm : le complexe de jonction exon-
exon (EJC), qui est déposé 20-24 nucléotides en amont de la
jonction exon-exon, et le complexe de transcription/export
humain (hTREX). hTREX est composé du complexe hTHO
(lui même composé des protéines hHpr1, hTho2, fSAP79,
fSAP35 et fSAP24), de l’ARN hélicase UAP56 et des pro-
téines REF et Thoc3. Des études récentes ont montré que
la protéine CBP80 qui est associée à la coiffe et les facteurs
déposés sur la première jonction exon-exon coopérent pour
recruter hTREX. Il existe donc un couplage entre les diffé-
rentes étapes de maturation des ARNm et l’étape d’épissage
s’avère cruciale pour un export ainsi qu’une traduction effi-
cace des ARNm cellulaires (figure 1). Et, en effet, il a été
montré que les ARNm produits à partir de gènes contenant
Virologie, Vol 17, n◦2, mars-avril 2013 97
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 26/05/2017.

Journal Identification = VIR Article Identification = 0483 Date: April 4, 2013 Time: 3:4 pm
revue
au moins un intron sont plus stables et s’accumulent plus
efficacement dans le cytoplasme que les mêmes ARNm
produits à partir de leurs ADNc.
Chez les mammifères, seulement 5 % des gènes codant
des protéines ne contiennent pas de séquence intronique.
Parmi ces gènes, certains codent des protéines ayant un
rôle très important dans la cellule comme les histones, le
facteur c-Jun du complexe AP1, la protéine de choc ther-
mique HSPB3, ou les protéines IFN à effet antiviral. Les
ARNm produits à partir de ces gènes dépourvus d’intron
sont stables et s’accumulent aussi efficacement que les
autres ARNm. Ils utilisent en fait des voies d’export spé-
cifiques, impliquant également les protéines SRp20, REF
et TAP/p15 mais de fac¸on indépendante de l’épissage. Ces
voies sont peu décrites. On pense cependant qu’elles per-
mettraient une régulation plus rapide et plus efficace de
l’expression de ces protéines.
Contrairement aux gènes cellulaires, la majorité des gènes
des herpesvirus ne contient pas d’intron. Les différents
herpesvirus (tableau 1) ont en commun de posséder un
génome à ADN double-brin linéaire de 150 à 230 kpb
dont la réplication a lieu dans le noyau de la cellule hôte.
Si peu de gènes sont exprimés lors de la latence de ces
Tableau 1. Principales caractéristiques des herpesvirus humains. Ces virus sont classés dans trois sous-familles en fonction :
(i) de leur tropisme cellulaire in vivo, (ii) de la durée de leur cycle de réplication et (iii) de leur classification phylogénique. Les
alphaherpesvirus peuvent infecter un large spectre de types cellulaires, ont un cycle productif très rapide et une latence dans
les ganglions nerveux. Les betaherpesvirus ont un spectre d’hôte intermédiaire, un cycle productif lent et une latence dans les
leucocytes. Les gammaherpesvirus peuvent infecter un spectre de types cellulaires restreint, ont un cycle productif d’une
durée intermédiaire et une latence principalement dans les lymphocytes B.
Nom
commun
Nom
formel
Genre Sous-famille Pathologie en
primoinfection
Autres pathologies
associées
Taille du
génome
(kpb)
Facteur
d’export
des ARNm
HSV-1 HHV-1 Simplexvirus alphaherpesvirus Aphtes, pharyngite Herpès orofacial,
encéphalite
152 ICP27
HSV-2 HHV-2 Simplexvirus alphaherpesvirus Herpès génital Herpès génital 156 ICP27
VZV HHV-3 Vaticellovirus alphaherpesvirus Varicelle Zona 125 IE4
EBV HHV-4 Lymphocryptovirus gammaherpesvirus Mononucléose
infectieuse
Nombreux cancers 172 EB2
CMV HHV-5 Cytomegalovirus betaherpesvirus Syndrome mimant
la mononucléose
infectieuse
Hépatite, rétinite,
pneumonie
248 UL69
HHV-6 HHV-6A
et B
Roseolovirus betaherpesvirus Roséole Roséole, Encéphalite.
Myocardites.
160 U42
HHV-7 HHV-7 Hoseolovirus betaherpesvirus Roséole Roséole 145 U42
KSHV HHV-8 Rhadinovirus gammaherpesvirus Sarcome de Kaposi,
maladie de
Castelman, souvent
associé au sida
170 ORF57
HSV : herpes simplex virus ; HHV-3 : human herpesvirus ; VZV : Varicella Zona virus ; EBV : Epstein-Barr virus ; CMV : human cytomegalovirus ; KSHV :
Kaposi’s sarcoma-associated herpesvirus.
virus, la majorité des gènes est exprimée pendant la phase
de production de nouveaux virions. Ce cycle productif
se décompose en quatre phases (figure 2) : après réac-
tivation du cycle, les gènes dits immédiats précoces qui
codent pour des facteurs de transcription sont exprimés.
Il y en a deux dans le cas d’EBV, appelés EB1 et Rta.
Ces protéines transactivatrices sont nécessaires pour induire
l’expression des gènes dits précoces dont les produits sont
requis soit pour la réplication de l’ADN viral, qui dépend
d’un complexe de réplication codé par le virus, soit pour
l’expression des gènes dits tardifs. Après réplication de
l’ADN viral, les gènes dits tardifs sont exprimés. Les pro-
duits de ces gènes sont soit des protéines de structure du
virus, soit des protéines impliquées dans la modulation de
la réponse cellulaire comme l’IL10 virale. Pour l’EBV, les
dix gènes exprimés pendant la phase de latence ainsi que
les gènes très précoces du cycle productif sont des gènes
avec introns, mais la majorité des gènes précoces ainsi que
la quasi-totalité des gènes tardifs sont dépourvus d’intron
(figure 2). Chez les herpès simplex de type I (HSV-1), sur
environ 80 gènes exprimés au cours de l’infection virale,
seuls cinq contiennent des introns. L’accumulation cyto-
plasmique de ces ARNm viraux issus de gènes dépourvus
98 Virologie, Vol 17, n◦2, mars-avril 2013
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 26/05/2017.

Journal Identification = VIR Article Identification = 0483 Date: April 4, 2013 Time: 3:4 pm
revue
ARNm issus de
gènes sans
intron
Production de
particules virales
infectieuses
Expression des
gènes tardifs
LCL
Réplication
du génome viral
Infection
CYCLE
PRODUCTIF
In vitro, induction par
des agents
chimiques (TPA/BA)
LATENCE
Expression des gènes
immediats précoces
(EB1, R)
Expression des
gènes précoces
... EB2 ...
ARNm issus
de gènes avec
introns
Figure 2. Cycle viral productif d’Epstein-Barr virus (EBV) dans les cellules in vitro. Suite à l’infection, le virus EBV entre en phase de
latence durant laquelle il n’y a pas de production de virion mais des gènes codant pour des protéines impliquées dans le maintien du
génome viral et l’immortalisation des cellules sont exprimés. De cette phase de latence, il peut y avoir activation du cycle productif. In vitro,
le cycle productif peut être induit par des agents chimiques comme le TPA/BA ou biologiques comme le TGF-ß. L’activation est suivie d’une
expression séquentielle des gènes viraux : les protéines immédiates précoces permettent l’expression des gènes précoces, des produits
des gènes précoces sont impliqués dans la réplication de l’ADN viral qui est suivie par l’expression des gènes tardifs, lesquels codent pour
les protéines de structure du virus. LCL : lymphoblastoide cell line.
d’intron ne devrait pas poser de problème étant donné que
de tels ARNm existent dans la cellule et qu’ils sont effi-
cacement exportés dans le cytoplasme où ils sont traduits
en protéine. Cependant, cela n’est vrai que pour un petit
nombre d’ARNm viraux issus de gènes dépourvus d’intron.
Les autres requièrent la présence d’une protéine virale pour
s’accumuler efficacement dans le cytoplasme de la cellule
hôte. Ces protéines sont EB2 chez EBV, ICP27 chez HSV-1,
IE4 chez le virus Varicelle et Zona (VZV), ORF57 chez
le virus du sarcome de Kaposi (KSHV) et UL69 chez le
cytomégalovirus (CMV) (tableau 1). Cette revue a pour
objectif, à travers notamment l’exemple de la protéine
EB2 du virus EBV, de décrire ces facteurs et de montrer
leur implication dans l’expression de certaines protéines
virales.
EB2 est indispensable à la production
de virions
La protéine EB2 (aussi appelée Mta ou SM) a initialement
été identifiée comme un facteur nécessaire à la transcription
des gènes viraux précoces et tardifs du virus. Ce n’est que
Virologie, Vol 17, n◦2, mars-avril 2013 99
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 26/05/2017.

Journal Identification = VIR Article Identification = 0483 Date: April 4, 2013 Time: 3:4 pm
revue
plus tard qu’il a été montré qu’EB2 n’agit pas au niveau de
l’initiation de la transcription des gènes viraux, mais durant
les étapes post-transcriptionnelles [1].
Afin d’étudier plus précisément le rôle de cette protéine
dans le cycle viral productif, un virus EBV recombinant
amputé du gène codant pour la protéine EB2 a été généré
[2]. Ainsi, il a pu être montré que, suite à l’induction du
cycle viral productif, les cellules infectées par un EBV
recombinant n’exprimant pas EB2 ne produisent pas de par-
ticules virales. Lorsque ce déficit est trans-complémenté par
l’expression ectopique d’EB2, des virions sont de nouveau
efficacement produits [2]. De manière intéressante, les pro-
téines analogues des autres herpesvirus (ICP27 de HSV1,
ORF57 de KSHV et IE4 de VZV) sont également indis-
pensables à la production de nouvelles particules virales
dans leurs modèles d’infection respectifs. Seule la pro-
téine UL69 du virus CMV ne semble pas indispensable
à la production de virions, mais la cinétique de produc-
tion est beaucoup plus lente qu’avec le virus sauvage [3].
Cependant, si ces protéines semblent avoir des fonctions
équivalentes, elles ne sont pas interchangeables. Ainsi,
le remplacement de la séquence codante d’ICP27 par la
séquence d’EB2 dans un virus HSV-1 restaure en partie la
production de particules virales, mais uniquement lorsque
l’infection est réalisée avec une très grande quantité de virus
[4]. ICP27, UL69, et ORF57 ne restaurent pas la produc-
tion de virions à partir de cellules infectées par un EBV
recombinant amputé du gène codant la protéine EB2 [2].
Réciproquement, EB2 est incapable de trans-complémenter
un virus KSHV recombinant amputé du gène codant ORF57
[5].
La caractérisation plus précise du recombinant EBV
n’exprimant pas la protéine EB2 a permis de mieux
comprendre le rôle d’EB2 dans la production de nouveaux
virions et notamment de confirmer le rôle majeur de ce fac-
teur dans l’accumulation cytoplasmique de certains ARNm
viraux. Ces ARNm ont la particularité d’être produits à par-
tir de gènes dépourvus d’intron. En absence de la protéine
EB2, ils sont soit complètement absents, soit présents en
quantité bien inférieure, et cela tant dans le noyau que dans
le cytoplasme de la cellule hôte. Il est cependant à noter que
tous les ARNm d’EBV produits à partir de gènes dépourvus
d’intron ne requièrent pas la protéine EB2 pour s’accumuler
efficacement dans le cytoplasme cellulaire [2, 6]. Ainsi, une
étude transcriptomique a permis de montrer qu’environ la
moitié des ARNm du cycle productif d’EBV sont dépen-
dants d’EB2 pour leur accumulation cytoplasmique [7]. La
protéine EB2 n’a, par ailleurs, pas d’effet significatif sur les
quelques ARNm viraux issus de gènes avec introns.
Ainsi, la protéine EB2 est nécessaire à la production de nou-
veaux virions car elle permet l’accumulation cytoplasmique
d’une proportion importante des ARNm viraux produits au
cours du cycle productif.
Structure du facteur viral EB2
et de ses analogues
La protéine virale EB2 est codée par le gène
BSLF2/BMLF1 qui contient un intron et est expri-
mée précocement au cours du cycle productif du virus
EBV (figure 2). C’est une phosphoprotéine nucléaire de
479 acides aminés (60 kDa). Sa structure n’a pour l’instant
pas été élucidée mais certains domaines importants pour sa
fonction ont néanmoins été mis en évidence : elle contient,
dans sa partie N-terminale, un signal d’export nucléaire
(NES) atypique et deux signaux de localisation nucléaire
(NLS). Par ailleurs, elle renferme dans sa partie centrale
un domaine d’interaction avec l’ARNm (RBD) et interagit
directement avec de nombreuses protéines cellulaires
(figure 3).
Comme EB2, ICP27, ORF57, UL69 et IE4 sont des phos-
phoprotéines issues de gènes précoces. Plusieurs motifs
NLS, un NES ainsi qu’un domaine d’interaction avec
l’ARN ont été caractérisés dans chacune de ces protéines
et il a été montré qu’elles interagissent avec certains par-
tenaires cellulaires communs, dont REF et TAP/NXF1
(figure 3). Cependant, malgré leurs fonctions analogues,
ces protéines ne présentent que très peu de similarité de
séquence et comme vu précédemment, elles ne sont pas
interchangeables.
Ainsi, bien que ces protéines virales aient des propriétés
communes, elles possèdent également des caractéristiques
spécifiques qui les distinguent les unes des autres.
EB2, comme ses analogues,
a des propriétés de facteur d’export
des ARNm
EB2 possède certaines caractéristiques des facteurs
d’export des ARNm. La première de ces caractéristiques
est sa capacité à faire la navette entre le noyau et le cyto-
plasme de la cellule [8] grâce à deux séquences NLS et
à un motif NES [9]. L’analyse simple de la localisation
cellulaire d’EB2 par immunofluorescence révèle une pré-
sence d’EB2 dans le seul noyau des cellules. Sa propriété
de navette n’a pu être démontrée que par l’utilisation de la
technique des hétérocaryons interespèces. Cette technique
consiste à faire fusionner une cellule exprimant la protéine
EB2 avec une autre cellule ne l’exprimant pas en présence
d’inhibiteur de synthèse protéique. Si après la fusion, la pro-
téine est retrouvée dans les deux noyaux de l’hétérocaryon,
on peut alors conclure que la protéine, bien que nucléaire,
peut sortir du noyau et y rentrer à nouveau (figure 4). Il est
intéressant de noter que le domaine NES d’EB2 ne présente
100 Virologie, Vol 17, n◦2, mars-avril 2013
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 26/05/2017.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%