Le système immunitaire :

Réalisé par le service scientifique LPEV.
Livret scientifique
Le système
immunitaire :
mécanismes
et rôle des micronutriments

1
I Les mécanismes de défenses vis-à-vis des infections hivernales 2
1. Les cellules épithéliales, première barrière contre les infections 2
2. Immunité innée 3
a. Reconnaissances des pathogènes 3
b. Les acteurs protéiques de l’immunité innée 4
c. Les acteurs cellulaires de l’immunité innée 4
d. Élimination des pathogènes 5
3. immunité acquise 5
a. Cellules principales de l’immunité adaptative 5
b. Reconnaissance et présentation de l’antigène 5
c. Activation des effecteurs spécifiques 5
d. Régulation de la RI 6
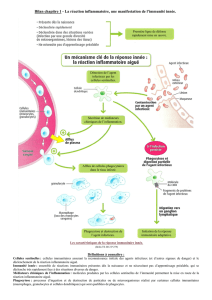
Ii Épidémiologie et physiopathologie des infections hivernales récidivantes 6
Iii La vitamine c 8
Iv Les probiotiques 9
V Références bibliographiques 10

2
Toutes les espèces animales sont confrontées de façon quo-
tidienne à un grand nombre de micro-organismes et d’aller-
gènes qui peuvent affecter leur santé et même leur survie.
Apparu très tôt dans l’échelle de l’évolution, le système im-
munitaire a évolué pour discriminer le « soi » du « non-soi ».
Deux systèmes de défense s’opposent aux micro-organismes :
un système appelé l’immunité innée, qui est commun à tous
les animaux, y compris l’homme, et un système immunitaire
dit adaptatif (ou spécifique) qui est présent exclusivement
chez les vertébrés. Ces deux systèmes complémentaires sont
capables de coopérer et la capacité du système immunitaire
inné à pressentir le danger est essentiel pour une réponse
adaptative efficace.
Quelles sont les différentes stratégies développées par les
mammifères pour se défendre de manière efficace vis-à-vis
des pathogènes et notamment des virus ? Quel est l’impact
des infections virales et bactériennes sur la population ? Quels
moyens complémentaires avons-nous pour nous prémunir de
ces pathologies récidivantes de l’hiver ?
I Les mécanismes de défenses vis-à-vis des infections
hivernales
1. Les cellules épithéliales, première barrière contre les
infections
La réponse immunitaire vis-à-vis d’agressions infectieuses
met successivement en œuvre un système de défense immé-
diat mais non spécifique (immunité innée), suivi d’un système
de défense spécifique très ciblé après quelques jours (immu-
nité adaptative).
La réponse immunitaire innée implique l’activation de macro-
phages, de polynucléaires neutrophiles, de cellules dendri-
tiques, de lymphocytes NK ainsi que des cellules épithéliales
ayant un contact avec le milieu extérieur, maintenant consi-
dérées comme de véritables cellules de l’immunité innée. Les
couches épithéliales de la peau et des tractus gastro-intesti-
nal, urogénital et respiratoire forment en effet une barrière
physique contre l’infection.L’épithélium de surface des voies
aériennes proximales assure notamment la protection de la
muqueuse respiratoire vis-à-vis de particules nocives inha-
lées et des virus et bactéries grâce à différents mécanismes,
comme la clairance muco-ciliaire, la régulation des flux d’ions
et d’eau et la sécrétion de molécules de défense (Figure 1) 18.
La protection des voies aériennes est assurée également par
des complexes jonctionnels intracellulaires responsables de
l’étanchéité de l’épithélium (jonctions serrées, jonctions inter-
médiaires et desmosomes).
Figure 1 : Systèmes de défense de l’épithélium respiratoire des voies
aériennes (Coraux et al., Med. Sci., 2005 18).
Au niveau de la muqueuse gastro-intestinale, le microbiote
résident peut interférer avec l’adhérence et les effets toxiques
des pathogènes. Les 100 000 milliards de bactéries qui le
constituent jouent notamment un rôle très important dans
la maturation du système immunitaire des muqueuses, et
plus particulièrement le développement des structures lym-
phoïdes organisées, le recrutement des lymphocytes B et
T dans la lamina propria et la sécrétion d’IgA et de peptides
antimicrobiens dans la lumière intestinale. Les cellules épithé-
liales jouent quant à elles non seulement un rôle de barrière
physique, représenté par le mucus ou encore les jonctions ser-
rées, mais également de barrière chimique liée notamment
à la production de peptides antimicrobiens (Figure 2). Une
troisième fonction des cellules épithéliales, qui complète ce
rôle de défense immédiate, est la sécrétion de chimiokines
capables de recruter les cellules plus classiques de l’immunité
innée, polynucléaires et/ou macrophages. L’expression de ces
chimiokines est inductible à travers une cascade de signali-
sation déclenchée par la liaison de motifs microbiens à des
récepteurs.
Enfin, la défense immunitaire humorale spécifique des sur-
faces muqueuses est contrôlée principalement par les im-
munoglobulines sécrétoires de type IgA (S-IgA), anticorps pré-
dominants des sécrétions humaines. La production des IgA
spécifiques dirigée contre des pathogènes muqueux ou des
antigènes protéiques solubles est T-dépendante.

3
2. Immunité innée
a. Reconnaissances des pathogènes
L’immunité innée est génétiquement programmée pour dé-
tecter les caractères invariants des microbes envahisseurs.
Les cellules de l’immunité innée sont entre autres les cel-
lules dendritiques (CD), les macrophages, les neutrophiles et
les cellules NK. Les senseurs microbiens et viraux les mieux
caractérisés de l’immunité innée sont des récepteurs recon-
naissant certains motifs des micro-organismes encore appe-
lés PRR (« pattern recognition receptors »). Ces récepteurs re-
connaissent des motifs moléculaires invariants présents chez
la plupart des micro-organismes que l’on appelle des motifs
moléculaires associés aux pathogènes ou PAMP (« pathogen-
associated molecular pattern»). Ces PRR peuvent être divisés
en différentes catégories : les PRR sécrétés, transmembra-
naires ou cytosoliques.
Les PRR sécrétés sont les collectines, les ficolines, et les pen-
traxines. Ils se fixent à la surface des micro-organismes et ac-
tivent la voie classique et la voie des lectines de la cascade
du complément. Cette opsonisation des pathogènes permet
leur phagocytose par les macrophages et les neutrophiles.
Les PRR transmembranaires sont les Toll-like récepteurs ou
TLR (Figure 3). Ces TLR sont soit extracellulaires, ancrés au ni-
veau la membrane plasmique des cellules soit intracellulaires,
ancrés au niveau de la membrane des endosomes et des lyso-
somes. Les TLR de surface reconnaissent des PAMP présents à
la surface des bactéries tels que le lipopolysaccharide (LPS),
l’acide lipotechoïque, les lipoprotéines bactériennes et la
flagelline. Les TLR intracellulaires quant à eux reconnaissent
les acides nucléiques bactériens et viraux tels que les ARN
double et simple brin et l’ADN double brin.
Les PRR cytosoliques comptent des ARN hélicases tels que
RIG-1 et MDA5 qui sont capables de reconnaître l’ARN viral
et les NLR (pour NOD-like recepteur) connus pour être des
détecteurs intracellulaires de l’infection bactérienne. Ces NLR
sont divisés en plusieurs sous familles dont les NLRP (NLRP
pour NOD-like receptors) 36;46. Leur activation peut mener à
la formation d’un complexe moléculaire appelé l’inflamma-
some 3;28;53;54 qui permet la maturation de l’IL-1b (pro-inflam-
matoire) et de l’IL-18. L’IL-18 collabore ensuite avec l’IL-12 pour
stimuler la production d’IFN-g 54;73.
L’activation des PRR active généralement NF-kB ou des fac-
teurs de régulation des interférons (IRF) induisant ensuite la
transcription de gènes codant pour des cytokines pro-inflam-
matoires, des interférons de type I (IFN-a et b) ou des IFN de
type II (IFN-g) 39.
Figure 2 : Systèmes de défense de l’épithélium gastro-intestinal (adaptée de Lievin-Le et al., Clin. Microbiol. Rev., 2006 (47)).

4
b. Les acteurs protéiques de l’immunité innée
Cette cascade du complément est constituée d’une trentaine
de protéines et peut être activée de différentes manières. Pre-
mièrement, par la voie classique faisant intervenir des anti-
corps liés à l’antigène dans des complexes immuns ou des
pentraxines 6;22. Deuxièmement, la voie alternative qui est
déclenchée par la fixation de la molécule C3b du complément
directement à la surface des cellules microbiennes 80 et enfin
la voie des lectines qui fait intervenir des facteurs solubles, la
MBL et les ficolines 25;55;56. Le complément intervient dans une
variété de réactions immunitaires comprenant le déclenche-
ment de la réponse immunitaire, l’attraction des phagocytes,
la stimulation de la phagocytose par opsonisation, l’attaque
directe de cellules microbiennes ou de virus à enveloppe et la
stimulation de la production d’anticorps 22.
c. Les acteurs cellulaires de l’immunité innée
Les basophiles, les mastocytes et les éosinophiles jouent tous
un rôle dans la protection des surfaces épithéliales, en par-
ticulier les muqueuses des tractus gastro-intestinal, respira-
toire et urogénital. Ces cellules opèrent principalement dans
la défense immunitaire contre les parasites qui sont trop
grands pour être digérés par les phagocytes.
Les neutrophiles, les macrophages et des CD sont des cel-
lules dites cellules phagocytaires professionnelles et sont ca-
pables de reconnaître les pathogènes grâce à leurs PRR et de
réaliser la phagocytose. Les neutrophiles et les macrophages
sont capables de détruire les micro-organismes ingérés. En
revanche, les CD ne sont pas destinées à la destruction mas-
sive des pathogènes mais sont nécessaires pour faire le lien
avec l’immunité acquise en présentant les particules ingé-
rées à leur surface aux lymphocytes T.
Les cellules natural killer ou NK assurent une protection pré-
coce contre les pathogènes intracellulaires et en particulier
contre les virus. Ces cellules sont capables de reconnaître les
cellules infectées en détectant la densité de CMH I dont l’ex-
pression est diminuée voire absente à cause de l’infection 38;68.
Ces cellules exercent une action cytotoxique et sécrètent une
cytokine pro-inflammatoire, l’IFN-g.
Toutes ces cellules jouent un rôle important dans le déclen-
chement de l’inflammation. La mise en place de ce proces-
sus, débute par la détection d’un micro-organisme par un
macrophage ou un mastocyte et induit la production de
TNF et de l’IL-1. Ces cytokines agissent sur les cellules voi-
sines pour produire davantage de cytokines jusqu’à ce que
la réponse atteigne les cellules endothéliales. Rapidement,
on observe une modification des propriétés d’adhérence de
l’endothélium, puis les neutrophiles pénètrent dans les tissus
par diapédèse (transmigration des leucocytes entre deux cel-
lules endothéliales) 45 et sont attirés par chimiotactisme vers
le site de l’infection où ils attaquent les microbes 45;58. Le TNF,
l’IL-1 et les IFN de type I produits par les macrophages sur le
lieu de l’infection peuvent également attirer et activer les NK
et induire leur effet cytotoxique envers les bactéries ou les
virus en produisant de l’IFN-g 17.
Figure 3 : Reconnaissance des PAMP par les TLR transmembranaire (Kawai et Akira, Nat.Rev., 2010, 39)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%