30/10/14 OCANA Marine L2 Relectrice : Borg Manon TSSI

TISSU SANGUIN ET SYSTEME IMMUNITAIRE - Inflammation
30/10/14
OCANA Marine L2
Relectrice : Borg Manon
TSSI
Pr G. KAPLANSKI
22 pages
INFLAMMATION
La réaction inflammatoire est un mécanisme de défense essentiel à l'organisme qui se développe contre une
agression tissulaire et dont la nature est variable. Le plus souvent elle survient suite à l'entrée d'un agent
microbien, mais il peut aussi s'agir d'une blessure tissulaire stérile qui n'est pas d'origine infectieuse.
Le but de cette réaction va être de circonscrire l'agent agresseur, de le détruire et de revenir à l'état de base du
tissu, c'est-à-dire à l'homéostasie.
Pour cela il y a des mécanismes qui permettent aux globules blancs circulants de passer hors de la circulation
et de gagner le tissu où se situe l'agent agresseur pour pouvoir le circonscrire et le détruire. Ces mécanismes se
font par étape, d'abord la margination, puis l'extravasation et enfin la migration tissulaire des leucocytes.
Mais tout ceci ne peut pas se faire sans entraîner des dommages collatéraux. Alors, pour que la réaction
inflammatoire soit bénéfique à l’organisme, il faut qu'elle soit limitée dans le temps et dans l'espace. Sinon,
le tissu va être trop détruit, il ne pourra pas se reconstituer à l'état de base et il y aura des séquelles. C'est ce que
l'on appelle la réaction inflammatoire aiguë. Cette réaction est tout à fait favorable à l'organisme dans 99,5 %
des cas et indispensable à la vie.
Cependant, lorsque cette inflammation devient chronique ou trop importante, trop diffuse (elle n'est plus assez
limitée dans le temps et dans l'espace), elle devient responsable d'un certain nombre de maladies que l'on
qualifie alors de maladies inflammatoires.
1/22
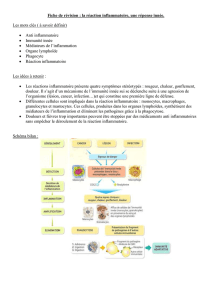
Plan :
PARTIE 1 : La réaction inflammatoire aiguë
A. La phase vasculaire
B. La phase cellulaire
I. Les cellules impliquées
II. Les médiateurs solubles : les cytokines et les chimiokines
III. Les médiateurs membranaires : les molécules d'adhésion
IV. La cascade adhésive leuco-endothéliale
V. La migration trans-endothéliale
VI. Le passage à travers la matrice extra-cellulaire
C. La phase résolutive
I. La fin de la réaction inflammatoire
II. Comment induit-on l'inflammation ?
PARTIE 2 : La réaction inflammatoire chronique
A. La dérégulation du système inflammatoire : la maladie auto-inflammatoire
B. La persistance de l'agent agresseur
C. L'auto-immunité
D. La dérégulation due à un état anormal chronique

TISSU SANGUIN ET SYSTEME IMMUNITAIRE - Inflammation
Globalement, la réaction inflammatoire apparaît avant l'immunité adaptative (avec les lymphocytes T et B,
les anticorps). Mais une fois la réponse immunitaire adaptative réalisée, la réponse inflammatoire peut
constituer le « bras armé » de la réponse adaptative. C'est-à-dire que lorsque l'on a développer des anticorps,
lors d'un deuxième contact avec la bactérie ces anticorps vont être présents et entraîner une réponse
inflammatoire beaucoup plus limitée, efficace, qui va permettre d'éliminer plus facilement la bactérie. La
réaction inflammatoire est donc à la fois plus précoce, mais peut aussi préparer le terrain pour la réponse
immunitaire adaptative.
Dans l'évolution des espèces la réaction inflammatoire est apparue beaucoup plus précocement que la réponse
adaptative. D'ailleurs il y a des êtres vivants qui ne possèdent que des mécanismes de défense inflammatoire
sans avoir développé un système immunitaire plus évolué.
Les mécanismes inflammatoires n'ont pas de mémoire, ils ne sont pas modulés par un deuxième ou un
troisième contact avec l'agent agresseur, contrairement au système immunitaire adaptatif. Ce qui signifie que si
l'on ne possédait que la réponse inflammatoire, le premier contact comme le deuxième ou le troisième, avec le
même agent agresseur, entraînerait exactement le même type de réponse.
La réponse inflammatoire peut se développer suite à une agression microbienne (bactéries, virus, parasites,...).
Mais l'inflammation peut aussi être déclenchée par des mécanismes non microbiens dit stériles. Ils sont moins
faciles à appréhender. C'est probablement le cas le plus fréquent.
Par exemple :
–la crise de goutte qui est due à la précipitation de cristaux d'acide urique. Il y a une arthrite importante
avec une intense inflammation articulaire mais il n'y a pas de bactérie. C'est bien quelque chose de
stérile, ici les cristaux, qui induit une inflammation.
–Les personnes en contact avec la silice peuvent développer une maladie très grave appelée la silicose,
c'est une inflammation chronique du poumon. Cette maladie est due à l’inhalation de la silice qui est une
substance que l'on n'arrive pas à éliminer de notre organisme. Ici aussi ce n'est pas un agent microbien
qui est responsable.
–Le cas le plus fréquent est la nécrose cellulaire. Par exemple si on tombe d'une échelle, on va avoir un
traumatisme musculaire avec une nécrose musculaire au niveau du muscle écrasé par la chute. Il va
apparaître un hématome, donc une inflammation locale. Il n'y a pas d'infection. Et c'est exactement la
même chose qui se passe dans les cas d'ischémie aiguë, par exemple lors d'un infarctus du myocarde
ou d'un AVC des cellules meurent et délivrent des signaux de danger à l'organisme qui vont entraîner
une réaction inflammatoire.
Donc ces inflammations d'origine stérile sont très importantes et il ne faut pas les négliger par rapport aux
inflammations d'origine microbienne.
PARTIE 1 : LA REACTION INFLAMMATOIRE AÏGUE
C'est un mécanisme de défense essentiel à la survie et favorable à l'organisme. La réaction inflammatoire ne se
fait pas n'importe où. Pour que les leucocytes puissent quitter la circulation et passer dans les tissus il faut des
conditions physiques particulières dans lesquelles le flux sanguin est relativement lent et les vaisseaux sont
poreux.
Cela se passe principalement au niveau des capillaires et des veinules post-capillaires (très bas dans les
ramifications vasculaires). A ce niveau là, la vitesse du flux sanguin est très ralentie, par rapport à la sortie du
cœur ou de l'aorte, et les leucocytes peuvent plus facilement venir au contact de la paroi endothéliale.
2/22

TISSU SANGUIN ET SYSTEME IMMUNITAIRE - Inflammation
Lorsque l'agent agresseur pénètre dans un tissu, on va avoir au niveau des capillaires et des veinules post-
capillaires qui vascularisent le tissu trois phases qui vont se succéder dans le temps :
–Première phase : la phase vasculaire. Elle va survenir assez rapidement, en quelques minutes, et va
durer de quelques minutes à quelques heures. Elle est caractérisée par un phénomène de
vasodilatation qui ralentit encore la vitesse du flux sanguin. Il y a aussi une augmentation de la
perméabilité capillaire, et enfin la constitution d'un phénomène de coagulation localement. Tous ces
éléments favorisent une fuite de protéines plasmatiques dans les tissus. Cliniquement ça correspond à
un œdème.
–Deuxième phase : la phase cellulaire. Elle met quelques heures à apparaître, et va durer de quelques
heures à quelques jours. C'est la phase essentielle, le corpus de l'inflammation. Au cours de cette
phase les leucocytes vont adhérer à la paroi endothéliale, migrer au travers de l'endothélium pour
atteindre les tissus et détruire l'agent agresseur responsable du signal de danger. La destruction de
l'agent agresseur va entraîner des lésions collatérales.
–Troisième phase : la phase résolutive. Pendant cette phase la réaction inflammatoire va s'arrêter, les
leucocytes ne vont plus être recrutés, et il va falloir reconstituer le tissu lésé autour de l'agression. Des
mécanismes de réparation tissulaire sont mis en place pour récupérer les fonctions tissulaires
normales.
A. La phase vasculaire
Elle se caractérise par une vasodilatation et une augmentation de la perméabilité capillaire. Elle résulte de
l'action de nombreux médiateurs protéiques ou lipidiques vaso-actifs, avec une action rapide sur le tonus
vasculaire et la perméabilité capillaire.
Si on réfléchit on peut se dire que, pour que quelque chose se passe en quelques minutes, il ne peut pas y avoir
de synthèse protéique classique (qui prend au mieux 1 à 2h). Donc les protéines doivent être préformées et
non actives. Il y a alors plusieurs solutions :
–Il y a des médiateurs préformés et stockés à l'intérieur de granulations contenues dans les cellules.
C'est le cas de l'histamine et de la sérotonine qui sont deux protéines possédant une activité
vasodilatatrice importante. Ces protéines sont contenues dans les granulations des mastocytes. Quand
le mastocyte ne dégranule pas, ces protéines n'ont pas d'action et inversement, le mastocyte peut
dégranuler très rapidement et libérer ces protéines à forte action vasodilatatrice directement activées.
3/22

TISSU SANGUIN ET SYSTEME IMMUNITAIRE - Inflammation
–D'autres protéines plasmatiques circulent à l'état inactif et peuvent s'activer rapidement en cas de
signal de danger. Il y a principalement le facteur de contact Hageman (XII) et les protéines du
complément qui dérivent de l'activation du complément, notamment par la voie interne du complément
activée et rétro-contrôlée en permanence par des mécanismes de régulation négative. Donc dès qu'il y a
un signal de danger, la voie interne du complément s'active et permet la libération de protéines du
complément (C3a, C5a et C4a qui sont des anaphylatoxines) au fort pouvoir vasoactif.
–Il peut y avoir également des substances synthétisées rapidement. Globalement ça ne peut pas être des
protéines, mais ça peut être des lipides. Ce sont des médiateurs qui sont synthétisés et sécrétés en
quelques minutes. Ce sont en particulier des dérivés de l'acide arachidonique provenant lui-même des
phospholipides membranaires. L'acide arachidonique donne naissance aux prostaglandines (qui ont
un fort pouvoir vasodilatateur particulièrement les prostaglandines E2 et I2) et à d'autres substances
que sont les leucotriènes et le facteur d'agrégation plaquettaire (PAF) qui jouent moins sur la
vasodilatation mais plus sur le recrutement cellulaire.
Donc les médiateurs sont soit préformés et stockés, soit circulant à l'état inactif et s'activant rapidement, soit
synthétisés en quelques minutes et d'origine lipidique.
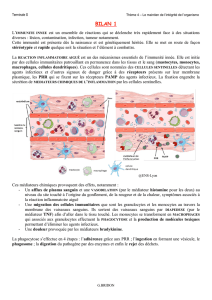
Pour le schéma ci-dessus : à partir des phospholipides membranaires, grâce à l'action de la phospholipase
A2, est synthétisée l'acide arachidonique. Celui-ci peut être soit modifié par les cyclooxygénases et donner
naissance aux prostaglandines (E2 et I2 extrêmement vasodilatatrices) ; soit donner naissance via les
lipooxygénases à la voie des leucotriènes ayant une action chimiotactique et faisant le lien avec la phase
cellulaire (2ème phase de la réaction inflammatoire).
Dans les voies d'activation du complément il y a différents mécanismes : certains dépendent du système
immunitaire et des anticorps : c'est la voie classique ; d'autres dépendent d'un contact avec des peptides ou
avec des substances d'origine microbienne, c'est la voie alterne. Cette voie s'active lorsqu'il y a contact et
donne naissance à des substances comme le C3a ou le C5a qui ont une activité vasodilatatrice importante.
4/22

TISSU SANGUIN ET SYSTEME IMMUNITAIRE - Inflammation
B. La phase cellulaire
I. Les cellules impliquées
a. Les leucocytes
Ils appartiennent à différentes familles de cellules :
→ Les mastocytes :
Ce sont des cellules qui ont un rôle important, bien au delà de l'allergie. Elles dérivent des basophiles et
résident dans les tissus en contact avec l'extérieur (les voies aériennes, les voies digestives, la peau).
Les mastocytes sont des cellules sentinelles puisqu'ils sont dans des tissus en contact avec l'extérieur, mais
aussi parce qu'ils possèdent à leur surface un certain nombre de récepteurs qui agissent comme des « radars ».
Il y a les récepteurs qui reconnaissent la partie Fc des IgE et des IgG ( FcεR et FcγR), les récepteurs au
complément, les récepteurs Toll qui leur permettent de capter les dangers d'origine infectieuse, et les
récepteurs pour certaines cytokines. Les mastocytes ont donc à leur surface tout un système de
reconnaissance de signaux de danger.
De plus ils sont armés pour répondre rapidement à une stimulation. Ils vont participer à la phase vasculaire de
l'inflammation car ils possèdent dans leur cytoplasme des granulations (avec à l’intérieur de l'histamine, de la
sérotonine et des eicosanoides) très rapidement mobilisées et libérées hors de la cellule en cas d'activation. De
même via leurs phospholipides membranaires, ils peuvent synthétiser l'acide arachidonique (pour donner à
la fin des prostaglandines) et possèdent donc une capacité de réponse rapide pour un signal de danger qui va
leur permettre d'induire la phase vasculaire de l'inflammation.
Les mastocytes ont aussi une capacité de réponse plus lente et plus prolongée. Dans leur noyau cellulaire se
trouve de l'ADN à partir duquel sont synthétisées des protéines dont les cytokines et les chimiokines qui ont
une activité pro-inflammatoire importante, notamment dans la phase cellulaire de l'inflammation.
Cellules sentinelles premièrement car elles sont résidentes au carrefour avec l'extérieur, deuxièmement car possèdent sur
leur membrane une variété de récepteurs pour capter les dangers, troisièmement parce qu'elles ont une capacité de
réponse rapide via la dégranulation et la production de prostaglandines leur permettant de participer à la phase
vasculaire de l'inflammation, quatrièmement parce qu'elles possèdent un mécanisme de réponse plus lent et plus prolongé
leur permettant de synthétiser des cytokines inflammatoires et de participer à la phase cellulaire de l'inflammation.
→ Les polynucléaires neutrophiles :
Ce sont les principales cellules effectrices de la réaction inflammatoire. En effet ces cellules sont très
nombreuses.
Aussi elles ont une capacité d'infiltration tissulaire importante car elles expriment à leur surface des
molécules adhésives (L-sélectine, ICAM-1, bêta2 intégrine) qui leur permettent d'adhérer à l'endothélium, au
sous-endothélium, et donc de passer des cellules endothéliales aux tissus.
De plus, elles possèdent à leur surface des récepteurs pour les substances chimiotactiques (C5a, LT, PAF,
chimiokines), sécrétées par les cellules infectées par exemple, et qui vont attirer ces leucocytes vers le lieu de
l'infection. Ces substances chimiotactiques ont donc besoin d'être reconnues par ces récepteurs particuliers à 7
domaines transmembranaires et largement représentés à la surface du neutrophile.
Tout ça ne serait rien si il n'avait pas la possibilité de bouger. Le neutrophile est une cellule qui a un appareil
locomoteur important qui lui permet de se mouvoir, de se déplacer dans les tissus.
5/22
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
1
/
22
100%