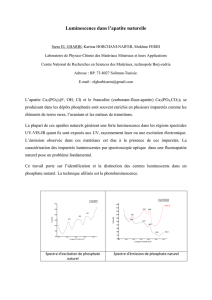
1. DENOMINATION DU MEDICAMENT Fludarabine Sandoz

1. DENOMINATION DU MEDICAMENT
Fludarabine Sandoz 25 mg/ml solution à diluer injectable ou pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un flacon de 2 ml contient 50 mg phosphate de Fludarabine.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution à diluer injectable ou pour perfusion
Solution claire incolore ou quasi incolore.
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
Traitement de leucémie lymphoïde chronique (LLC) à cellules B chez les patients ayant des réserves
médullaires suffisantes.
Le traitement en première ligne avec Fludarabine Sandoz doit uniquement être initié chez les patients
en stade avancé de la maladie, Rai stades III/IV (Binet stade C) ou Rai stades I/II (Binet stade A/B)
lorsque le patient présente des symptômes associés à la maladie ou a des indications d’une maladie
progressive.
4.2 Posologie et mode d’administration
Fludarabine Sandoz ne peut être administré que sous surveillance d’un médecin spécialisé en
chimiothérapie antinéoplasique.
Il est fortement recommandé d'administrer Fludarabine Sandoz uniquement par voie intraveineuse. Il
n'a été rapporté aucun cas de réaction locale sévère indésirable à la suite d'une administration
paraveineuse de Fludarabine Sandoz. Cependant une administration paraveineuse accidentelle doit
être évitée.
•Adultes
La dose recommandée est de 25 mg de Fludarabine Sandoz /m2 de surface corporelle,
administrée par voie intraveineuse, chaque jour, en cure de 5 jours consécutifs (= 1 cycle) tous
les 28 jours.
La dose nécessaire (calculée sur base de la surface corporelle du patient) est aspirée dans la
seringue. Pour une injection intraveineuse en bolus, il faut diluer ensuite cette dose dans 10 ml de
solution de chlorure de sodium 9 mg/ml (0,9 %) pour injection. Variante : pour une perfusion
intraveineuse d'environ 30 minutes, la dose requise peut être diluée dans 100 ml de solution de
chlorure de sodium 9 mg/m (0,9 %) pour injection (voir aussi rubrique 6.6).
La durée optimale du traitement n’est pas déterminée univoquement. La durée du traitement
dépend du résultat du traitement et de la tolérance vis-à-vis du produit.
Il est recommandé d'administrer Fludarabine Sandoz jusqu'à l'obtention de la meilleure réaction
(généralement en 6 cycles), ensuite le traitement sera interrompu.
•Insuffisance hépatique
Aucune donnée n'est disponible concernant l'usage de Fludarabine Sandoz chez les patients
atteints d’insuffisance hépatique. Chez ce groupe de patients, Fludarabine Sandoz doit être utilisé
avec précaution et administré si le bénéfice attendu dépasse tout risque potentiel. Tels patients
1

devraient être contrôlés méticuleusement sur toxicité augmenté. Le dosage du médicament est à
modifier à l’avenant ou bien le traitement doit être arrêté (voir aussi rubrique 4.4).
•Insuffisance rénale
La clairance totale du principal métabolite plasmatique 2F-ara-A est corrélée à celle de la
créatinine sérique, ce qui démontre l'importance de l'excrétion rénale pour l'élimination du
produit. Chez les patients atteints d'insuffisance rénale, une augmentation de l'exposition
corporelle totale a été démontrée (AUC du 2F-ara-A). Peu de données cliniques sont disponibles
pour les patients atteints d'insuffisance rénale (clairance de la créatine sérique < 70 ml/min.).
C'est pourquoi il est nécessaire de mesurer la clairance de la créatinine en cas de présomption
clinique d'insuffisance rénale et chez les patients de plus de 70 ans. Si la clairance de la
créatinine sérique est comprise entre 30 et 70 ml/min, la dose doit être réduite jusqu'à 50 % et
une surveillance hématologique étroite doit être instaurée pour évaluer la toxicité. Le traitement
par Fludarabine Sandoz est contre-indiqué si la clairance de la créatinine sérique est inférieure à
30 ml/min.
•Enfants et jeunes personnes
L’administration de Fludarabine Sandoz chez les enfants et les jeunes personnes n’est pas
recommandée parce qu’il n’y a pas de données disponibles concernant l’innocuité et l'efficacité.
•Personnes âgées
Les données cliniques étant limitées chez les patients âgés (> 75 ans), l'administration de
phosphate de Fludarabine doit se faire avec précaution chez ces patients (voir 4.4).
4.3 Contre-indications
•Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique 6.1,
•Insuffisance rénale avec clairance de la créatinine < 30 ml/min,
•Anémie hémolytique décompensée,
•Allaitement.
4.4 Mises en garde spéciales et précautions d’emploi
Neurotoxicité
Lors d'utilisation à doses élevées dans les études de recherche de dose chez des patients atteints de
leucémie aiguë, le phosphate de fludarabine intraveineux a été associé à des effets neurologiques
sévères, notamment une cécité, un coma et un décès. Les symptômes sont apparus entre 21 et 60 jours
après l'administration de la dernière dose. Cette toxicité sévère sur le système nerveux central s'est
produite chez 36% des patients traités par voie intraveineuse avec des doses approximativement
quatre fois plus élevées (96 mg/m²/jour pendant 5 à 7 jours) que la dose recommandée. Chez les
patients traités avec des doses figurant dans la fourchette des doses recommandées pour la leucémie
lymphoïde chronique, une toxicité sévère sur le système nerveux central s'est produite dans de rares
cas (coma, crises convulsives et agitation) ou de façon peu fréquente (confusion). Il faut surveiller les
patients de près pour détecter des signes d'effets neurologiques.
L'effet sur le système nerveux central d'une administration chronique de phosphate de fludarabine
n'est pas connu. Cependant, des patients ont toléré la dose recommandée dans certaines études
pendant des périodes de traitement relativement longues (jusqu'à 26 cures).
L’expérience acquise après la mise sur le marché du produit a montré qu'une neurotoxicité se produit
plus tôt ou plus tard que dans les études cliniques.
État de santé altéréChez les patients présentant un mauvais état général, le phosphate de Fludarabine
doit être administré avec précaution et après avoir soigneusement pris en compte le rapport
bénéfice/risque. Ceci s'applique particulièrement aux patients ayant un déficit sévère de la fonction de
la moelle osseuse (thrombocytopénie, anémie et/ou granulocytopénie), une immunodéficience ou des
antécédents d'infections opportunistes.
2

Insuffisance hépatique
Chez les patients atteints d’insuffisance hépatique, le phosphate de Fludarabine doit être administré
avec précaution car ça peut aboutir à une toxicité hépatique. Par conséquent, le phosphate de
Fludarabine sera administré uniquement si le bénéfice attendu dépasse le risque potentiel. Ces patients
doivent être étroitement surveillés afin de déceler toute toxicité excessive. Le dosage du médicament
est à modifier à l’avenant ou bien le traitement doit être arrêté (voir aussi rubrique 4.2).
Insuffisance rénale
La clairance corporelle totale du principal métabolite plasmatique, le 2-F-ara-A, présente une
corrélation avec la clairance de la créatinine, ce qui montre l’importance de la voie d’excrétion rénale
pour l’élimination du produit. Les patients à fonction rénale réduite ont présenté une augmentation de
l’exposition corporelle totale (AUC du 2F-ara-A). Les données cliniques relatives aux patients
présentant une atteinte de leur fonction rénale (clairance de la créatinine < 70 ml/min) sont limitées.
Le phosphate de fludarabine doit être administré avec précaution chez les insuffisants rénaux. Chez
les patients présentant une insuffisance rénale modérée (clairance de la créatinine comprise entre 30 et
70 ml/min), la dose doit être réduite jusqu'à 50% et le patient doit faire l'objet d'une surveillance
étroite (voir rubrique 4.2). Un traitement par phosphate de fludarabine est contre-indiqué si la
clairance de la créatinine est < 30 ml/min (voir rubrique 4.3).
Myélosuppression
Des myélosuppressions sévères notamment anémies, thrombocytopénies, neutropénies ont été
rapportées chez les patients traités par le phosphate de Fludarabine, Dans une étude de phase I en
administration intraveineuse chez des adultes atteints de tumeurs solides, le délai médian pour
atteindre le nadir a été de 13 jours (extrêmes: de 3 à 25 jours) pour les granulocytes et de 16 jours
(extrêmes: de 2 à 32 jours) pour les plaquettes. La plupart des patients présentaient initialement une
perturbation hématologique, soit en raison de leur maladie, soit du fait d’une thérapie
myélosuppressive antérieure. On peut observer une myélosuppression cumulative. Comme la
myélosuppression induite par la chimiothérapie est souvent réversible, l'administration de phosphate
de Fludarabine nécessite une surveillance hématologique soigneuse.
Le phosphate de Fludarabine est un puissant agent antinéoplasique qui potentiellement peut induire
des effets indésirables toxiques de façon significative. Il faut surveiller de près les patients qui
reçoivent un traitement afin de détecter des signes de toxicité hématologique et non hématologique.
Un contrôle régulier de la numération des cellules sanguines périphériques est recommandée, afin de
détecter le développement d'une anémie, d'une neutropénie ou d'une thrombocytopénie.
Plusieurs cas d’hypoplasie ou d’aplasie médullaire portant sur trois lignées ayant entraîné une
pancytopénie, et parfois le décès, ont été rapportés chez des patients adultes. Dans les cas rapportés, la
durée de la cytopénie cliniquement significative a varié entre environ 2 mois et environ 1 an. Ces
épisodes se sont produits à la fois chez des patients précédemment traités ou non traités.
Comme avec d’autres produits cytotoxiques, le phosphate de Fludarabine doit être utilisé avec
précaution si on envisage de prélèvement de cellules souches hématopoïétiques.
Maladie du greffon contre l'hôte (GVH) post-transfusionnelle
Une maladie du greffon contre l'hôte (réaction de lymphocytes immunocompétents transfusés contre
l’hôte) liée à la transfusion a été observée après la transfusion de sang non irradié chez des patients
traités par phosphate de fludarabine. Une issue fatale résultant de cette maladie a été rapportée à une
fréquence élevée. Dès lors, pour minimiser le risque de maladie post-transfusionnelle du greffon
contre l’hôte, les patients nécessitant une transfusion, qui sont ou ont été traités par phosphate de
fludarabine, ne doivent recevoir que du sang irradié.
Cancer cutané
Une aggravation ou une poussée de lésions cutanées cancéreuses préexistantes ou l’apparition d'un
nouveau cancer cutané ont été rapportées chez certains patients pendant ou après un traitement par
phosphate de fludarabine.
Syndrome de lyse tumorale
3

Un syndrome de lyse tumorale a été rapporté chez des patients présentant d'importants fardeaux
tumoraux. Comme le phosphate de fludarabine peut induire une réponse dès la première semaine de
traitement, des précautions doivent être prises chez les patients qui risquent de développer cette
complication.
Maladies auto-immunes
Indépendamment de tout antécédent de processus auto-immuns ou des résultats du test de Coombs, on
a signalé que des phénomènes auto-immuns (par exemple anémie hémolytique auto-immune,
thrombocytopénie auto-immune, purpura thrombocytopénique, pemphigus, syndrome d'Evans)
mettant en jeu le pronostic vital ou parfois fatals se produisent pendant ou après le traitement avec
phosphate de Fludarabine. La majorité des patients souffrant d’une anémie hémolytique a dévéloppé
un récidive du processus hémolytique après un nouveau traitement par phosphate de Fludarabine.
Les patients traités par phosphate de fludarabine doivent être étroitement surveillés pour détecter la
survenue de signes d’hémolyse.
Les patients traités par phosphate de Fludarabine doivent faire l'objet d'une attention particulière
quant à la survenue d'une anémie hémolytique auto-immune (chute de l'hémoglobine associée à une
hémolyse et à un test de Coombs positif). L'interruption du traitement par phosphate de Fludarabine
est recommandée en cas d’ hémolyse. La transfusion sanguine (sang irradié, voir plus haut) et les
préparations adrénocorticales constituent le traitement le plus usuel de l'anémie hémolytique auto-
immune.
Sujets âgés
Les données concernant l'utilisation de phosphate de fludarabine chez les patients âgés (> 75 ans)
étant limitées, la prudence est de rigueur lorsqu'on administre du phosphate de fludarabine chez ces
patients.
Chez les patients âgés de 65 ans et plus, la clairance de la créatinine doit être mesurée avant le début
du traitement (voir "Insuffisance rénale" et rubrique 4.2).
Enfants et jeunes personnes
On ne dispose pas de données concernant l’administration de phosphate de Fludarabine chez les
enfants et les jeunes personnes. Pour cette raison, le traitement par phosphate de Fludarabine n’est pas
recommandé chez les enfants et les jeunes personnes.
Grossesse
Le phosphate de fludarabine ne doit pas être utilisé pendant la grossesse à moins que cela ne soit
clairement nécessaire (par ex., situation mettant en danger le pronostic vital du patient, absence
d’alternative thérapeutique plus sûre sans compromettre le bénéfice thérapeutique, traitement ne
pouvant être évité). Il peut être préjudiciable pour le fœtus (voir rubriques 4.6 et 5.3). Les
prescripteurs ne peuvent envisager d’utiliser le phosphate de fludarabine que si les bénéfices
éventuels justifient les risques potentiels pour le fœtus.
Les femmes doivent éviter toute grossesse pendant leur traitement par phosphate de fludarabine.
Les femmes en âge de procréer doivent être informées du risque potentiel pour le fœtus.
Contraception
Les femmes en âge de procréer ou les hommes fertiles doivent prendre des mesures contraceptives
efficaces pendant le traitement et pendant au moins 6 mois après l'arrêt du traitement (voir rubrique
4.6).
Vaccination
Pendant et après le traitement par phosphate de Fludarabine, une vaccination avec des virus vivants
doit être évitée.
Options de retraitement après un traitement initial par fludarabine
Un cross-over d'un traitement initial avec Fludarabine au chlorambucil chez les patients ne répondant
pas à la Fludarabine doit être évité parce que la plupart des patients qui ont été résistants à la
Fludarabine ont montré une résistance au chlorambucil.
4

4.5 Interactions avec d’autres médicaments et autres formes d’interaction
Au cours des essais cliniques utilisant phosphate de Fludarabine intraveineux en association avec la
pentostatine (deoxycoformycine) dans le traitement des leucémies lymphoïdes chroniques (LLC)
réfractaires, l’incidence élévée d'accidents pulmonaires mortels était inacceptable. C’est pourquoi
l’utilisation de phosphate de Fludarabine en association avec la pentostatine est deconseillée.
Le dipyridamole et d'autres inhibiteurs de la recapture de l'adénosine peuvent
diminuer l'efficacité thérapeutique du phosphate de fludarabine.
Une interaction pharmacocinétique entre le phosphate de Fludarabine et l’Ara-C a été observée chez
les patients atteints de LLC et de LAM (leucémies aiguës myéloïdes). Des études cliniques et des
expériences in vitro ont montré que pendant l'utilisation de phosphate de fludarabine combiné à de la
cytarabine, le pic de concentration intracellulaire et l’exposition intracellulaire à l’Ara-CTP (le
métabolite actif de la cytarabine) augmentaient dans les cellules leucémiques.Les concentrations
plasmatiques d’Ara-C et les taux d‘élimination d’Ara-CTP n’ont pas été modifiés.
4.6 Grossesse et allaitement
Grossesse
Les données précliniques chez le rat ont démontré un passage du phosphate de fludarabine et/ou de
ses métabolites à travers le placenta. Les résultats des études d’embryotoxicité effectuées chez le rat et
le lapin par voie intraveineuse ont indiqué un potentiel embryolétal et tératogène aux doses
thérapeutiques (voir rubrique 5.3).
On ne dispose que de données très limitées concernant l'utilisation du phosphate de fludarabine chez
des femmes enceintes pendant le premier trimestre.
Le phosphate de fludarabine ne doit pas être utilisé pendant la grossesse à moins que cela ne soit
clairement nécessaire (par ex., situation mettant en danger le pronostic vital du patient, absence
d’alternative thérapeutique plus sûre sans compromettre le bénéfice thérapeutique, traitement ne
pouvant être évité). Le phosphate de fludarabine a la possibilité d'induire un préjudice au fœtus. Les
prescripteurs ne peuvent envisager d’utiliser le phosphate de fludarabine que si les bénéfices
éventuels justifient les risques potentiels pour le fœtus.
Les femmes en âge de procréer doivent être informées du risque potentiel pour le fœtus.
Les hommes sexuellement actifs et les femmes en âge de procréer doivent prendre des mesures
contraceptives efficaces pendant le traitement et pendant au moins 6 mois après l'arrêt du traitement
(voir rubrique 4.4).
Allaitement
On ne sait pas si ce médicament ou ses métabolites sont excrétés dans le lait humain.
Toutefois, les études précliniques ont montré que le phosphate de fludarabine et/ou ses métabolites
passent du sang maternel au lait.
En raison de la possibilité de réactions indésirables graves au phosphate de fludarabine chez les
enfants nourris au sein, le phosphate de fludarabine est contre-indiqué chez les mères qui allaitent
(voir rubrique 4.3).
4.7 Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
L'effet de la Fludarabine sur l'aptitude à conduire des véhicules et à utiliser des machines n'a pas été
évalué.
Cependant, le phosphate de fludarabine peut diminuer l'aptitude à conduire et à utiliser des machines,
puisqu'on a observé de la fatigue, de l'asthénie, des troubles visuels, de la confusion, de l'agitation et
des crises convulsives.
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%