L`atome ouverture sur le monde quantique

TS Page 1
L’atome ouverture sur le monde quantique
I Systèmes atomique
I.a Les découvertes
1897 :J.J Thomson découvre une particule négative élémentaire de la matière :
l’électron.
1911 : Rutherford montre que l’atome est fait essentiellement de vide. Au centre de
l’atome un noyau positif.
rutherford-scattering.jnlp
I.b Modèle planétaire de l’atome
En 1911 Rutherford
modélise l’atome par
un système solaire
miniature. Un noyau de
charge positive autour
du quel gravite les
électrons chargés
négativement.
I.c Limite de la mécanique de Newton
Les lois de la mécanique de Newton ne peuvent pas expliquer au moins 2 phénomènes pour
des objets aussi petits que les atomes :
L’effet photoélectrique
Le spectre atomique
I.c.1 L’effet photoélectrique : 1887
photoelectric.jnlp

TS Page 2
L’effet photoélectrique a été mis en
évidence par Heinrich HERTZ en
1887.
On charge négativement un
électroscope sur lequel est
placée une lame de zinc.
On éclaire cette plaque avec
une lampe qui émet une
lumière riche en UV (une lampe
à halogène, par exemple)
L’électroscope se décharge alors
rapidement.
Si l'on interpose sur le trajet de
la lumière une lame de verre
qui absorbe le rayonnement
ultraviolet, l'électroscope ne se
décharge plus
Interprétation :
Les UV arrache les électrons du zinc :
c’est l’effet photo électrique.
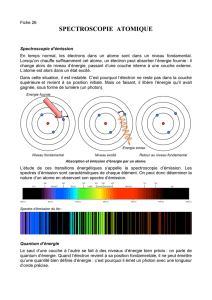
I.c.2 Le spectre atomique
Si on applique les lois de la mécanique classique (c’est dire la mécanique de Newton), les
prévisions théoriques s’écartent de l’expérience sur au moins 3 points :
La mécanique de Newton appliquée aux
atomes prévoit :
Observations expérimentales
Spectre d’émission continu des
atomes
Le spectre d’émission des atomes est discontinu
L’électron devrait s’écraser sur le noyau
en quelques nanosecondes (car perte
d’énergie par rayonnement
électromagnétique : équation de
Maxwell)

TS Page 3
L’agitation thermique devrait modifier la
taille des atomes d’un même élément
Toutes les mesures montrent que les atomes d’un
même élément semblable.
Bilan : La mécanique classique ne peut expliquer le comportement des particules à l’échelle
atomique.
II Quantification de l’énergie d’un atome
II.a Naissance de la physique quantique
L’énergie d’un atome ne peut prendre que certaines valeurs discrètes appelées niveaux
d’énergie.
A chaque atome correspond un ensemble unique de niveaux d’énergie discret.
II.b Etat fondamentale et état excité d’un atome
Ci-contre les niveaux d’énergie de l’atome
d’hydrogène. Si on donne une énergie de
13,6 ev à l’atome, il s’ionise.
Autrement dit il faut que le photon (grain de
lumière) possède une énergie au moins
supérieure à 13,6 eV dans le cas de
l’hydrogène.
II.c La lumière onde ou particule ?
On fait l’hypothèse que la lumière est une particule (photon) à laquelle on peut lui associer une
onde de fréquence (en Hz) et de longueur d’onde
E : énergie du photon en J
: Fréquence en Hz
(Constante de Planck)
On peut aussi écrire que l’énergie d’un photon est :
Interference_par_deux_fentes.wmv

TS Page 4
II.d Spectre d’émission
Lorsqu’un électron passe du niveau E
3
au
niveau E
2
, l’électron perd de l’énergie sous
forme de radiation (lumière) tel que :
Bilan :
Un atome ne peut émettre que certaines
fréquences bien définies. Le spectre est donc
discontinu.
II.e Spectres d’absorption atomique
hydrogen-atom.jnlp
Transition atomique depuis un état
d’énergie E
j
vers un état d’énergie
supérieure E
i
par absorption d’un photon de
fréquences
Emission et absorption de photons lors d’une
transition entre deux niveaux d’énergie.
1
/
4
100%