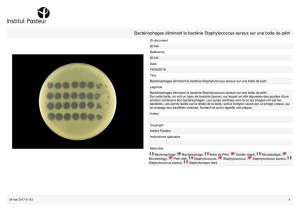
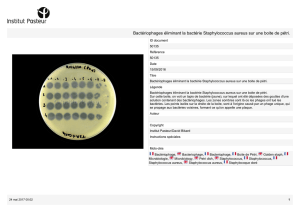
etude de l influence des antibiotiques a concentrations sub

http://portaildoc.univ-lyon1.fr
Creative commons : Paternité - Pas d’Utilisation Commerciale -
Pas de Modification 2.0 France (CC BY-NC-ND 2.0)
http://creativecommons.org/licenses/by-nc-nd/2.0/fr
BERAUD
(CC BY-NC-ND 2.0)

UNIVERSITE CLAUDE BERNARD - LYON 1
FACULTE DE PHARMACIE DE LYON
INSTITUT DES SCIENCES PHARMACEUTIQUES ET BIOLOGIQUES
Année 2014 THESE n° 03-2014
MEMOIRE DU DIPLOME D’ETUDES SPECIALISEES
DE BIOLOGIE MEDICALE
Travail effectué dans le Laboratoire de Bactériologie – Pr LINA
Centre Hospitalier Lyon Sud - Hospices Civils de Lyon
Sous la direction du Dr Oana DUMITRESCU
présenté et soutenu publiquement le 14 mars 2014 par
Mademoiselle BERAUD Laetitia
Née le 23 Novembre 1985 à St Etienne
Conformément aux dispositions du décret n°90810 du 10 septembre 1990, tient lieu de thèse
T H E S E
POUR LE DIPLOME D'ETAT DE DOCTEUR EN PHARMACIE
*****
ETUDE DE L’INFLUENCE DES ANTIBIOTIQUES A CONCENTRATIONS
SUB-INHIBITRICES SUR L’EXPRESSION DES PSM CHEZ STAPHYLOCOCCUS AUREUS
*****
JURY
Président : Monsieur FRENEY Jean, Professeur des Universités – Praticien Hospitalier
Membres du Jury : Madame DUMITRESCU Oana, Maitre de Conférence des Universités –
Praticien Hospitalier
Monsieur LINA Gérard, Professeur des Universités – Praticien Hospitalier
Monsieur STEGHENS Jean-Paul, Praticien Hospitalier
Monsieur VANDENESCH François, Professeur des Universités –
Praticien Hospitalier
BERAUD
(CC BY-NC-ND 2.0)

2
UNIVERSITE CLAUDE BERNARD LYON 1
Président de l’Université M. François-Noël GILLY
Vice-Président du Conseil d’Administration M. Hamda BEN HADID
Vice-Président du Conseil Scientifique M. Germain GILLET
Vice-Président du conseil des Etudes et de la Vie Universitaire M. Philippe LALLE
Composantes de l’Université Claude Bernard Lyon 1
SANTE
UFR de Médecine Lyon Est Directeur : M. Jérôme ETIENNE
UFR de Médecine Lyon Sud Charles Mérieux Directrice : Mme Carole BURILLON
Institut des Sciences Pharmaceutiques et Directrice : Mme Christine VINCIGUERRA
Biologiques
UFR d’Odontologie Directeur : M. Denis BOURGEOIS
Institut des Techniques de Réadaptation Directeur : M. Yves MATILLON
Département de formation et centre de Directeur : Mme Anne-Marie SCHOTT
recherche en Biologie Humaine
SCIENCES ET TECHNOLOGIES
Faculté des Sciences et Technologies Directeur : M. Fabien DE MARCHI
UFR de Sciences et Techniques des Directeur : M. Yannick VANPOULLE
Activités Physiques et Sportives (STAPS)
Ecole polytechnique Universitaire de Lyon Directeur : M. Pascal FOURNIER
(ex ISTIL)
I.U.T. LYON 1 Directeur : M. Christophe VITON
Institut des Sciences Financières et Directrice : M. Nicolas LEBOISNE
d’Assurance (ISFA)
ESPE Directeur : M. Alain MOUGNIOTTE
BERAUD
(CC BY-NC-ND 2.0)

3
UNIVERSITE CLAUDE BERNARD LYON 1
ISPB – Faculté de Pharmacie Lyon
Directrice : Madame la Professeure Christine VINCIGUERRA
Directeurs Adjoints : Madame S. BRIANCON, Monsieur P. LAWTON, Monsieur P. NEBOIS
Madame S. SENTIS, Monsieur M. TOD
Directrice Administrative : Madame P. SILVEIRA
LISTE DES DEPARTEMENTS PEDAGOGIQUES
DEPARTEMENT PEDAGOGIQUE DE SCIENCES PHYSICO-CHIMIQUE ET PHARMACIE
GALENIQUE
• CHIMIE ANALYTIQUE, GENERALE, PHYSIQUE ET MINERALE
Monsieur Raphaël TERREUX (MCU-HDR)
Monsieur Pierre TOULHOAT (Pr-PAST)
Madame Julie-Anne CHEMELLE (MCU)
Monsieur Lars-Petter JORDHEIM (MCU)
Madame Christelle MACHON (AHU)
• PHARMACIE GALENIQUE – COSMETOLOGIE
Madame Stéphanie BRIANCON (Pr)
Madame Françoise FALSON (Pr)
Monsieur Hatem FESSI (Pr)
Madame Joëlle BARDON (MCU-HDR)
Madame Marie-Alexandrine BOLZINGER (MCU-HDR)
Madame Sandrine BOURGEOIS (MCU)
Madame Ghania HAMDI-DEGOBERT (MCU)
Monsieur Plamen KIRILOV (MCU)
Monsieur Fabrice PIROT (MCU-PH-HDR)
Monsieur Patrice SEBERT (MCU-HDR)
• BIOPHYSIQUE
Monsieur Richard COHEN (PU-PH)
Madame Laurence HEINRICH (MCU)
Monsieur David KRYZA (MCU-PH)
Madame Sophie LANCELOT (MCU-PH)
Monsieur Cyril PAILLER-MATTEI (MCU)
DEPARTEMENT PEDAGOGIQUE PHARMACEUTIQUE DE SANTE PUBLIQUE
• DROIT DE LA SANTE
Monsieur François LOCHER (PU-PH)
Madame Valérie SIRANYAN (MCU-HDR)
• ECONOMIE DE LA SANTE
Madame Nora FERDJAOUI MOUMJID (MCU-HDR)
Monsieur Hans-Martin SPÄTH (MCU)
Madame Carole SIANI (MCU-HDR)
• INFORMATION ET DOCUMENTATION
Monsieur Pascal BADOR (MCU-HDR)
• HYGIENE, NUTRITION, HYDROLOGIE ET ENVIRONNEMENT
Madame Joëlle GOUDABLE (PU-PH)
BERAUD
(CC BY-NC-ND 2.0)

4
• INGENIEURIE APPLIQUEE A LA SANTE ET DISPOSITIFS MEDICAUX
Monsieur Gilles AULAGNER (PU-PH)
Monsieur Daniel HARTMANN (Pr)
• QUALITOLOGIE – MANAGEMENT DE LA QUALITE
Madame Alexandra CLAYER-MONTEMBAULT (MCU)
Monsieur François COMET (MCU)
Monsieur Vincent GROS (MCU PAST)
Madame Pascale PREYNAT (MCU PAST)
• MATHEMATIQUES – STATISTIQUES
Madame Claire BARDEL-DANJEAN (MCU)
Madame Marie-Aimée DRONNE (MCU)
Madame Marie-Paule PAULTRE (MCU-HDR)
DEPARTEMENT PEDAGOGIQUE SCIENCES DU MEDICAMENT
• CHIMIE ORGANIQUE
Monsieur Pascal NEBOIS (Pr)
Madame Nadia WALCHSHOFER (Pr)
Monsieur Zouhair BOUAZIZ (MCU-HDR)
Madame Christelle MARMINON (MCU)
Madame Sylvie RADIX (MCU-HDR)
Monsieur Luc ROCHEBLAVE (MCU-HDR)
• CHIMIE THERAPEUTIQUE
Monsieur Roland BARRET (Pr)
Monsieur Marc LEBORGNE (Pr)
Monsieur Laurent ETTOUATI (MCU-HDR)
Monsieur Thierry LOMBERGET (MCU-HDR)
Madame Marie-Emmanuelle MILLION (MCU)
• BOTANIQUE ET PHARMACOGNOSIE
Madame Marie-Geneviève DIJOUX-FRANCA (Pr)
Madame Isabelle KERZAON (MCU)
Monsieur Serge MICHALET (MCU)
• PHARMACIE CLINIQUE, PHARMACOCINETIQUE ET EVALUATION DU MEDICAMENT
Madame Roselyne BOULIEU (PU-PH)
Madame Magali BOLON-LARGER (MCU-PH)
Madame Céline PRUNET-SPANO (MCU)
Madame Catherine RIOUFOL (MCU-PH)
DEPARTEMENT PEDAGOGIQUE DE PHARMACOLOGIE, PHYSIOLOGIE ET TOXICOLOGIE
• TOXICOLOGIE
Monsieur Jérôme GUITTON (PU-PH)
Monsieur Bruno FOUILLET (MCU)
Madame Sylvain GOUTELLE (AHU)
Madame Léa PAYEN (MCU – HDR)
• PHYSIOLOGIE
Monsieur Christian BARRES (Pr)
Monsieur Daniel BENZONI (Pr)
Madame Kiao Ling LIU (MCU)
Monsieur Ming LO (MCU-HDR)
BERAUD
(CC BY-NC-ND 2.0)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
1
/
111
100%