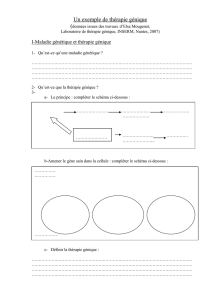
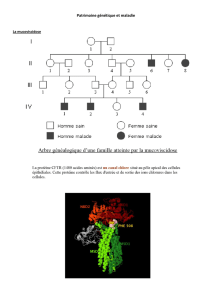
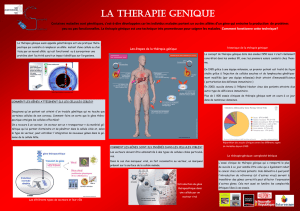
es missiles biologiqu pour détruire le cancer

NOTRE ÉPOQUE
es missiles biologiqu
pour détruire le cancer
Les
redresseurs
de gènes
La thérapie génique en est encore à ses premiers pas. Michel de Pracontal explique
comment elle va révolutionner la médecine de demain
E
n 1968, un jeune médecin frais émoulu
de l'université Harvard, le docteur
•
French Anderson, suggéra que l'on
pourrait un jour soigner des maladies
héréditaires en manipulant des gènes.
Le prestigieux « New England Journal of Medi-
cine » refusa son article, jugé « trop spéculatif».
Autant dire de la pure science-fiction 1 Aujour-
d'hui, French Anderson et son collègue Michael
Blaese sont mondialement connus pour avoir
réalisé la première thérapie génique. Dans leur
service du National Institute of Health (NIH) de
Bethesda, Maryland, une petite fille de 4 ans
reçoit depuis septembre 1990 un traitement basé
sur la manipulation de ses propres cellules. La
fillette souffre d'un déficit en ADA, une enzyme
indispensable à la défense de l'organisme. Sans
traitement, elle serait condamnée à vivre en
atmosphère stérile, comme un « enfant-bulle ».
Une autre équipe de Bethesda, dirigée par le
docteur Steven Rosenberg, vient de recourir à la
thérapie génique pour traiter deux patients at-
teints de mélanome malin, le plus meurtrier des
cancers de la peau. Rosenberg a manipulé leurs
lymphocytes pour les transformer en véritables
« lance-missiles » qui vont bombarder de substan-
ces anticancéreuses les cellules tumorales.
Un enfant sur cent naît avec un gène défectueux
hérité d'un de ses parents. Le déficit en ADA —
extrêmement rare puisqu'on connaît moins de
vingt cas dans le monde — n'est qu'une maladie
parmi les milliers résultant de ces défauts généti-
ques, comme la myopathie, la mucoviscidose ou
l'hémophilie. Dans l'avenir, on espère traiter non
seulement ces troubles héréditaires, mais aussi
des affections acquises, comme le parkinsonisme
ou même le sida. Et bien sûr les cancers : «
Dans
ce domaine, la thérapie génique ouvre une voie
très prometteuse, qui peut concerner tous les
types de tumeurs,
dit le professeur Thomas
66
LE NOUVEL OBSERVATEUR /NOTREÉPOQUE
Tursz, immunologue à l'Institut Gustave-
Roussy de Villejuif.
Cela va transformer la cancé-
rologie dans une perspective de deux à cinq ans. »
Porteuse d'immenses espoirs, la thérapie géni-
que se heurte encore à de nombreuses difficultés,
comme l'illustre la course d'obstacles qui a
conduit aux deux premières américaines. Norma-
lement, l'ADA est produite dans des cellules du
sang issues des « cellules souches » de la moelle.
Lorsque le gène qui commande sa fabrication est
défectueux, les cellules ne produisent pas d'ADA.
On peut y remédier par une greffe de moelle, mais
il n'existe pas forcément de donneur compatible.
On peut aussi injecter de l'ADA par voie intra-
musculaire, mais ce traitement doit être renouvelé
régulièrement. Le projet initial de French Ander-
son était d'introduire un gène fonctionnel dans les
cellules-souches de la moelle. Grâce à ce gène
« greffé », les enfants atteints par la maladie
auraient pu fabriquer de PADA tout au long de
leur existence, malgré leur défaut héréditaire.
En 1986, French Anderson soumet son projet
aux autorités du NIH. Mais les données expéri-
mentales ne sont pas convaincantes et le projet est
refusé. «
Toute thérapie génique met en jeu trois
éléments : un gène, une 'navette" pour le trans-
porter et une cellule cible où la navette doit
déposer le gène,
explique le docteur Pierre Lehn,
du département d'hématologie de l'hôpital
Saint-Louis.
En 1986,
on
ne
disposait pas
d'une
bonne navette pour atteindre les cellules souches
de la moelle. Même aujourd'hui on ne sait encore
le faire que chez la souris. »
Érench Anderson doit revoir ses ambitions à la
baisse. Parallèlement, son collègue Rosenberg a
développé une méthode pour cultiver et stimuler
les lymphocytes, des globules blancs du sang qui
jouent un rôle clé dans la défense immunitaire. On
dispose en outre d'une navette très efficace pour
transférer un gène dans les, lymphocytes. Cette
navette est un rétrovirus, c'est-à-dire un virus du
même type que celui du sida mais que l'on
neutralise (il s'agit d'un rétrovirus de souris,
inoffensif pour l'homme). Michael Blaese et
French Anderson ont transposé la technique de
Rosenberg au cas de l'ADA. Ils ont prélevé les
lymphocytes de leur jeune patiente, les ont culti-
vés, y ont transféré le gène ADA et les ont
réinjectés. En somme, on a fait faire aux lympho-
cytes le travail de la moelle. Inconvénient : alors
que les cellules souches de la moelle produisent
des lignées permanentes, les lymphocytes n'ont
qu'une durée de vie de quelque mois. Pour
conserver ses défenses immunitaires, la fillette
devra donc subir régulièrement des injections.
La technique des lymphocytes semble mieux
adaptée au traitement du cancer. Rosenberg
utilise des lymphocytes particuliers, les TIL —
pour
tumor infiltrating lymphocytes.
Ces TIL
ont la propriété de s'infiltrer dans les tumeurs, où
ils libèrent des substances qui attaquent les
cellules cancéreuses, mais à dose trop faible pour
combattre efficacement la maladie. Dans un
premier temps, Rosenberg a « dopé » les TIL avec
une substance qui stimule leur croissance, l'inter-
leukine-2. Encore fallait-il que ces TIL dopés
soient capables, une fois réinjectés au patient, de
retourner dans la tumeur d'où ils avaient été
prélevés. Pour le démontrer, Rosenberg a « ta-
toué » les TIL avec un gène neutre, qui permettait
de suivre les cellules à la trace. L'opération,
réalisée avec succès en 1990, préfigurait la théra-
pie génique. L'étape suivante, qui vient d'être
franchie, a consisté à doter les TIL d'un nouvel
armement : le gène du TNF —
turnor necrosis
factor —,
une molécule qui attaque les cellules
cancéreuses. Le TNF est produit naturellement
dans l'organisme, en petite quantité. Il est trop
tectique pour qu'on puisse l'injecter à doses
pharmacologiques. La manipulation de Rosen-
1
/
1
100%