Parcours Chimie (CH) Niveau L3 - SFA Poitiers

Université de POITIERS
Faculté des Sciences Fondamentales et Appliquées
3 rue Albert Turpain
86022 Poitiers Cedex – France
http://sfa.univ-poitiers.fr/
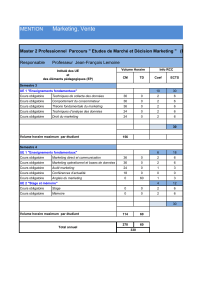
Licence Sciences, Technologies, Santé (STS)
Mention Physique, Chimie (PC)
Parcours Chimie (CH)
Niveau L3
S5
30 ECTS
Électrochimie
analytique
(ELEANA5)
54 h
6 ECTS
Chimie quantique
et applications
(QUANTA5)
60 h
6 ECTS
Réactivité en
Chimie
Organique
(REAORG5)
66 h
6 ECTS
Thermodynamique
chimique
(THERMO5)
60 h
6 ECTS
Anglais
20 h
Pré-
Professionnalisation
(PRE-PRO5)
23 h
6 ECTS
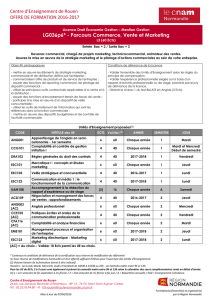
S6
30 ECTS
Méthodes
spectroscopiques
(SPECTRO6)
54 h
6 ECTS
Synthèse et
modélisations
(SYNMOD6)
60 h
6 ECTS
Chimie minérale :
structure et
réactivité
(MINSRE6)
66 h
6 ECTS
Cinétique et
Catalyse
(CINCAT6)
60 h
6 ECTS
Anglais
20 h
Pré-
Professionnalisation
(PRE-PRO6)
2 h + stage
6 ECTS
*UE en gris : mutualisation avec d’autres parcours : CAQ ou PC
Resp. : Cláudia GOMES DE MORAIS
Bureau 210 2ème étage nord –B27
05 49 45 39 73

CONTENU DES ENSEIGNEMENTS
SEMESTRE 5
ELEANA5 : Electrochimie analytique (18 h CM; 16 h TD ; 20 h TP)
UE mutualisée avec le parcours CAQ
B. Kokoh, A. Habrioux, K. Servat
- Transferts électroniques en solution.
- Diagrammes potentiel-pH.
- Aspects thermodynamiques de la réaction électrochimique.
- Piles et accumulateurs.
- Travaux pratiques d'électrochimie : potentiométrie, ampérométrie, conductimétrie, notions d'électrode, courbes
intensité-potentiel.
REAORG5 : Réactivité en chimie organique (22 h CM ; 22 h TD ; 22 h TP)
UE mutualisée avec le parcours PC
F. Lecornué, G. Anselme
- Additions sur alcènes et alcynes.
- Les organométalliques.
- Additions nucléophiles sur aldéhydes, cétones et imines.
- Addition-élimination sur les acides carboxyliques, chlorures d'acide, amides, nitriles, esters et anhydrides d'acide.
- Substitution en alpha d'un groupe carbonyle: énols et énolates; halogénation en alpha; alkylation des énolates et
énamines; réaction d'aldolisation et crotonisation; condensation de Claisen.
- Addition conjuguée.
- Oxydation. Réduction.
THERMO5 : Thermodynamique chimique (20 h CM; 22 h TD ; 12 h TP)
S. Mignard, S. Laforge
- Corps purs : comportement des gaz parfaits et des gaz réels.
- Enthalpie, enthalpie libre, entropie. Influence de la température et de la pression.
- Définition du potentiel chimique et ses variations en fonction des paramètres standard.
- Diagramme d'état d'un corps pur.
- Cas des mélanges : définition des grandeurs molaires partielles (volume, activité). Diagrammes ternaires.
QUANTA5 : Chimie quantique et applications (30 h CM; 24 h TD ; 6 h TP)
C. Bachmann, G. Frapper
- Introduction à la chimie quantique.
- Molécules et propriétés de symétrie
- Structures électroniques. Orbitales moléculaires.
- Réactivité et sélectivité en chimie moléculaire. Théorie des orbitales frontières. Règles de Woodward-Hoffmann.
- Méthodes de Hückel, calculs semi-empiriques et infographie.
PRE-PRO 5 : Pré-professionnalisation (6 h CM, 3 h TD + 14 h TP)
J. Robert
Informatique : identité numérique et vie privée
Outils d’aide à la recherche de stage et à l’insertion professionnelle
- Présentation et conférence d’institutionnels et professionnels.
- PEC, méthodologie de recherche de stage, CV, lettre de motivation, préparation à l’entretien.
- Introduction à la rédaction d’un rapport scientifique.
Réalisation d’un projet en autonomie (1ère partie – encadrement sur 3 h TD)
- Production d’un rapport pour évaluation à mi-parcours
ANGLAIS (20 h TD)
A. King
- Compréhension orale : entraînement à la compréhension orale de documents scientifiques et autres, exercices
d’approfondissement en laboratoire de langue.
- Expression orale et écrite : analyses des problèmes spécifiques ; approfondissement et révision de quelques
structures grammaticales ; expression écrite, aide à l’expression courante ; expression orale : exercices par paires.

SEMESTRE 6
SPECTRO6 : Méthodes spectroscopiques (26 h CM; 28 h TD)
UE mutualisée avec L3 CAQ
F. Richard, C. Gomes de Morais.
- Caractéristiques générales de la spectroscopie.
- Les atomes: structure et spectres.
- Spectroscopies moléculaires: spectres de rotation, vibration et électroniques.
- Spectroscopie RMN du proton et du carbone-13. Spectroscopie IR. Spectroscopie de masse.
- Identification de molécules organiques à l'aide des différentes techniques.
MINSRE6 : Chimie minérale : structure et réactivité (20 h CM; 26 h TD ; 20 hTP)
UE mutualisée avec L3 PC
L. Pirault-Roy, C. Fontaine
- Cristallochimie : structures-types binaires et ternaires, solutions solides, défauts cristallins, aspects énergétiques,
diagrammes de phases solide-liquide.
- Chimie des solutions : Réactions acido-basiques en solvant aqueux et non aqueux ; réactions de complexation et de
précipitation.
- Complexes de coordination : nomenclature, géométries, stabilité et approche de la théorie du champ cristallin.
- Rappels sur la classification périodique : Histoire et étymologie.
- Etude des éléments métalliques représentatifs des blocs s et d ; aspects fondamentaux et applications
industrielles.
CINCAT6 : Cinétique et catalyse (22 h CM; 16 h TD ; 16 h TP)
S. Laforge, F. Richard
- Généralités et définitions.
- Cinétique formelle en réacteur fermé: lois de vitesse et ordres de réaction.
- Théorie des vitesses de réaction: théorie des colisions et théorie de l'état de transition.
- Réactions élémentaires et réactions complexes. Mécanismes de réaction.
- Réactions composites.
- Catalyse: définition, cycle catalytique, exemples (catalyse homogène, hétérogène et enzymatique).
- Notion de réacteurs: bilan de matière dans les réacteurs continus et discontinus idéaux (3h CM, 4h TD).
- Travaux pratiques d'application (16h TP).
SYNMOD6 : Synthèse et modélisation moléculaire en chimie organique (4 h CM, 56 h TP)
A. Mingot, C. Bachmann
- Initiation à la recherche bibliographique.
- Mise en place et réalisation d'un projet de synthèse multi-étapes.
- Acquisition de compétences pratiques (utilisation des techniques usuelles de chimie organique ,microchimie,…).
- Utilisation des outils d'analyse qualitative, quantitative et structurale (techniques chromatographiques, RMN, IR,
SM,…).
- Initiation à la modélisation.
- Etude de la structure.
- Etude de la réactivité
PRE-PRO 6 : Pré-professionnalisation ( 2 h TD + stage)
J. Robert
Réalisation d’un projet en autonomie (2ème partie – encadrement sur 2 h TD)
- Production d’une fiche PEC d’analyse de projet
- Présentation orale du projet en anglais devant jury
Projet de fin de licence (Stage de 1 à 3 mois)
ANGLAIS (20 h TD)
A. King
- Compréhension orale.
- Expression orale et écrite.

MODALITES de CONTROLE des CONNAISSANCES
L'année L3 du parcours Chimie (CH) est divisée en deux semestres (S5 : 1er semestre et S6 : 2ème
semestre). Chaque semestre comporte cinq unités d'enseignement (UE) obligatoires. Les étudiants
absents à un enseignement doivent prendre contact avec l’enseignant responsable du parcours CH
dans un délai de 7 jours.
L'appréciation des aptitudes et des connaissances porte sur l'ensemble des matières enseignées et
donne lieu à une ou deux sessions suivant les UE d'examen par semestre suivant les UE :
S5 : 1ère session en décembre et 2nde session en juin ;
S6 : 1ère session en mai et 2nde session en juin.
Les différentes épreuves, examen terminal (ET) ou contrôle continu (CC) sont réparties en contrôles
écrits (E), oraux (O) et comptes rendus (CR) suivant les UE (cf. tableau ci-dessous). L’étudiant a
obligation de se rendre à toutes les épreuves, sauf cas particulier de dispense (demande préalable à
la Scolarité de SFA). La convocation aux différentes épreuves est faite par voie d'affiche. Aucune
convocation individuelle n'est envoyée.
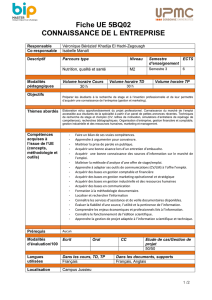
ECTS
1ère session
2nde session
CC 1
CC 2
CC 3
CC 4
Semestre 5
REAORG5 : Réactivité en chimie organique
6
2 (E)
3 (E)
3 (CR)
4 (E)
NON
THERMO5 : Thermochimie chimique
6
2 (CR)
2 (CR)
4 (E)
4 (E)
NON
ELEANA5 : Electrochimie analytique
6
2 (CR)
3 (E)
3 (O)
4 (E)
NON
QUANTA5 : Chimie quantique et applications
6
2 (CR)
3 (E)
3 (E)
4 (E)
NON
PRE-PRO5 : Pré-professionnalisation
3
2 (CR)
2 (CR)
2 (CR)
NON
ANGLAIS
3
2 (E)
2(O)
2
NON
Semestre 6
SPECTRO6 : Méthodes spectroscopiques
6
6 (E)
6 (E)
OUI
CINCAT6 : Cinétique et catalyse
6
2 (CR)
2 (CR)
4 (E)
4 (E)
NON
SYNMOD6 : Synthèse et modélisation
6
3 (CR)
3 (CR)
3 (CR)
3 (O)
NON
MINSRE6 : Chimie minérale : structure et réactivité
6
3 (E)
3 (E)
3 (E)
3 (CR)
NON
PRE-PRO6 : Pré-professionnalisation
3
2 (R)
2 (O)
2 (O)
NON
ANGLAIS
3
2 (E)
2 (O)
2
NON
E : écrit ; O : oral ; CR : comptes-rendus ; R : rapport
L'admission à une UE est prononcée à l'issue de l'ensemble des épreuves si la moyenne générale des
notes (affectées de leurs coefficients dont la somme est égale à 12) est supérieure ou égale à 10/20.
La compensation entre UE est semestrielle et annuelle. Le semestre est acquis si la moyenne générale
des notes des diverses UE constituant le semestre est supérieure ou égale à 10/20. L’année est
acquise si la moyenne des deux semestres est supérieure ou égale à 10/20. En cas d'échec au
semestre dans sa globalité, l'admission à une UE est définitive.
Crédits ECTS
Toutes les UE sont de poids équivalent en crédits ECTS à raison de 6 crédits par UE. L'obtention
d'une UE donne 6 ECTS, celle d'un semestre 30 ECTS, celle de l'année 60 ECTS.
1
/
4
100%