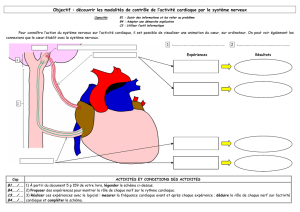
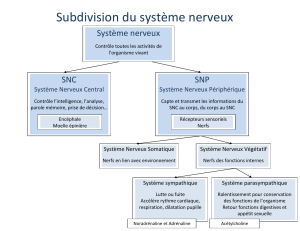
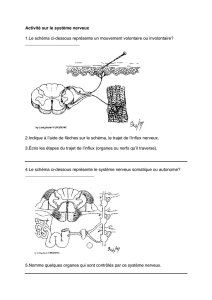
Madame claude SAIS

UMR 7224
Inserm Unité 952
Physiopathologie des Maladies du Système Nerveux Central
Physiopathologie des Maladies du Système Nerveux Central
Université Pierre et Marie Curie
9 Quai St Bernard
Bât. B - 4e étage (case courrier 37)
75252 PARIS CEDEX 05
01 44 27 25 01 - 01 44 27 61 59
Contacts :
Restauration de l’expression de CYP46A1 par transfert de gène :
un nouvel axe thérapeutique pour la maladie de Huntington
La maladie de Huntington (MH) est une maladie neurodégénérative caractérisée par des troubles moteurs,
psychiatriques et des déficits cognitifs. Aucun traitement curatif n’est disponible à ce jour et les traitements
symptomatiques restent peu efficaces. La transmission de la maladie est de type autosomique dominant dû à
une expansion de triplet CAG dans le gène htt codant la Huntingtin (HTT). Cette mutation entraine une
dysfonction neuronale menant à la dégénérescence des neurones du striatum, structure sous corticale du
système nerveux central. L’imagerie médicale a montré que le processus neurodégénératif commence une
quinzaine d’années avant l’apparition des symptômes. C’est pourquoi, il est crucial d’envisager une
intervention thérapeutique au cours de la période présymptomatique en vue d’une neuroprotection.
Jusqu’à présent il n’existe aucune thérapie efficace pour diminuer la progression de la maladie. Les essais
cliniques réalisés et en cours se sont essentiellement focalisés sur la transmission synaptique et sur
l’homéostasie énergétique. Cependant, la plupart des symptômes de la MH sont actuellement traités, quand
ils le sont, de façon inefficace. C’est pourquoi, la recherche clinique sur la MH demeure essentielle pour
traiter efficacement cette maladie. La stratégie thérapeutique la plus en amont consiste en la suppression de
l’allèle mutée dans la MH afin de supprimer tous les effets toxiques de la protéine mutée (mHTT).
Malheureusement, cette stratégie de ciblage spécifique des ARN mHTT n’a pas, jusqu’à présent, apporté de
succès thérapeutique. Une autre possibilité est d’identifier des biomarqueurs de la MH qui permettent de
révéler les stades précoces de la maladie et peuvent ainsi être utilisés pour promouvoir des molécules à visée
thérapeutique. Le métabolite issu du catabolisme du cholestérol dans le cerveau, le 24S-hydroxycholestérol
dosé dans le sérum de patients atteints de la MH a été récemment identifié comme étant un marqueur valable
de neurodégénérescence dans les phases très précoces de la MH. C’est pourquoi, CYP46A1, une protéine
neuronale et enzyme limitante catabolisant le cholestérol en 24S-hydroxycholestérol, pourrait directement
être impliqué dans les stades précoces de la pathogenèse de la MH.
Notre équipe « Signalisation Intracellulaire et Neuroadaptation » de l’unité de Physiopathologie des
Maladies du Système nerveux central s’intéresse depuis de nombreuses années à étudier la physiopathologie
de la maladie de Huntington afin d’identifier de nouvelles cibles thérapeutiques. Récemment, nous avons
montré que le niveau d’expression de CYP46A1 est diminué dans le striatum de souris modèle de la MH.
De plus, la surexpression de CYP46A1 dans les neurones striataux (i) diminuent la toxicité de la mHTT dans
des cultures primaires de neurones striataux et (ii) améliore le comportement moteur d’un modèle de souris
de la MH (résultats personnels). Nous pensons donc que cibler CYP46A1, l’enzyme clé du métabolisme du
cholestérol, représente une cible thérapeutique intéressante à étudier dans le but de diminuer le processus

UMR 7224
Inserm Unité 952
Physiopathologie des Maladies du Système Nerveux Central
Physiopathologie des Maladies du Système Nerveux Central
Université Pierre et Marie Curie
9 Quai St Bernard
Bât. B - 4e étage (case courrier 37)
75252 PARIS CEDEX 05
01 44 27 25 01 - 01 44 27 61 59
Contacts :
neurodégénératif dans la MH. Une diminution du catabolisme du cholestérol par CYP46A1 interviendrait
très précocement dans la pathogénèse de la MH et participerait au dysfonctionnement neuronal.
C’est pourquoi nous proposons de surexprimer CYP46A1 dans le striatum de modèles murins de la MH
en utilisant une stratégie particulièrement prometteuse et efficace de transfert de gènes utilisant un
adénovirus associé : l’AAVrh10.
L’utilisation de l’AAVrh.10 a le mérite de permettre une expression à long terme du transgène ainsi qu’un
bon niveau de surexpression de la protéine neuroprotectrice dans le striatum. Le phénotype des souris sera
étudié par des approches méthodologiques très complémentaires les unes par rapport aux autres :
comportement locomoteur, analyse histologique de marqueurs de la MH dans le striatum, dosages
biochimiques du cholestérol et du 24S-hydroxycholestérol, analyse de l’expression de gènes impliqués dans
l’homéostasie du cholestérol et une étude protéomique utilisant la spectrométrie de masse.
Les résultats prometteurs générés par cette étude permettront de mettre en évidence le rôle neuro-protecteur
de CYP46A1 dans la MH. De plus, la stratégie de thérapie génique adoptée au cours du projet est un point
de départ dans l’optique d’une thérapie efficace et durable chez les patients atteints de la MH.
Nous accueillons actuellement une étudiante de master 2 (UPMC neurosciences – SupBiotech) ayant une
formation d’expertise en biotechnologie qu’elle complète actuellement par un master 2 en neurosciences.
Nous vous proposons de participer à l’élaboration de ce projet par un contrat CIFRE dont le but est de
présenter des résultats scientifiques solides essentiels avant d’envisager des essais cliniques chez l’homme.
Les retombées cliniques de cette étude ne se limiteront pas à la MH puisque la stratégie de transfert de gènes
utilisant l’AAVrh10 dans le système nerveux central peut être aussi envisagée pour d’autres pathologies
neurodégénératives comme la maladie d’Alzheimer ou encore Parkinson.
1
/
2
100%