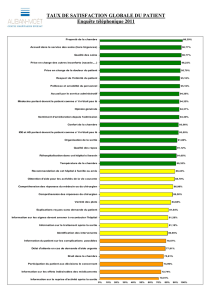
MACI, INN-Matrix applied characterised - EMA

Marketing Authorisation Suspended
1
ANNEXE I
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT

Marketing Authorisation Suspended
2
Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de
nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable
suspecté. Voir rubrique 4.8 pour les modalités de déclaration des effets indésirables
1. DÉNOMINATION DU MÉDICAMENT
MACI 500 000 à 1 000 000 cellules/cm2, matrice implantable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque implant contient des chondrocytes autologues cultivés, caractérisés, appliqués sur une matrice.
2.1 Description générale
Chondrocytes autologues viables caractérisés amplifiés ex vivo, exprimant des gènes marqueurs
spécifiques des chondrocytes, placés sur une membrane de collagène de type I/III d’origine porcine
marquée CE.
2.2 Composition qualitative et quantitative
Chaque matrice implantable se compose de chondrocytes autologues caractérisés disposés sur une
membrane de collagène de type I/III d’une surface de 14,5 cm², à raison de 500 000 à 1 000 000 cellules
par cm2, que le chirurgien devra couper afin de l'adapter à la taille et à la forme de la lésion.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Matrice implantable.
L’implant est une membrane blanc cassé opaque, sur laquelle sont disposés des chondrocytes, fournie
dans un récipient contenant 18 ml de solution incolore.
4. DONNÉES CLINIQUES
4.1 Indications thérapeutiques
MACI est indiqué pour la réparation des lésions symptomatiques du cartilage du genou de grade III et IV
sur l’échelle modifiée d’Outerbridge, d’une surface de 3 à 20 cm2, chez des patients adultes dont le
squelette est mature.
4.2 Posologie et mode d’administration
MACI est réservé à un usage autologue uniquement.
Son usage est reservé au milieu hospitalier. MACI ne doit être implanté que par un chirurgien
spécialement formé et qualifié pour son utilisation.

Marketing Authorisation Suspended
3
Posologie
La quantité de MACI à utiliser dépend de la taille de la lésion cartilagineuse (surface exprimée en cm2).
La matrice implantable est coupée par le chirurgien de manière à lui conférer la taille et la forme de la
lésion, la zone endommagée devant être complètement couverte. MACI doit être posé de telle sorte que
les cellules de l’implant se trouvent au contact de la lésion. La dose administrée est de 500 000 à
1 000 000 cellules autologues/cm2 de matrice implantable.
Populations particulières
Personnes âgées (plus de 65 ans)
L’utilisation de MACI chez les patients appartenant à cette tranche d’âge n’a pas fait l’objet d’études. Il
n’est pas recommandé d’utiliser MACI chez les personnes âgées présentant une dégénérescence
généralisée du cartilage ou une arthrose.
Population pédiatrique
La sécurité et l’efficacité de MACI chez les enfants âgés de moins de 18 ans n’ont pas été établies.
Aucune donnée n'est disponible.
Mode d’administration
Pour implantation.
Le lit de la lésion ne doit être débridé que jusqu’à la plaque sous-chondrale ; le débridement ne doit pas la
traverser. Il convient d’éviter tout saignement de la plaque sous-chondrale. Toutefois, si cela se produit,
celui-ci doit alors être maîtrisé. L’adrénaline ou une colle de fibrine directement appliquée sur les points
de saignement constitue un agent hémostatique approprié.
L’implantation de MACI est réalisée dans le cadre d’une intervention chirurgicale et doit être pratiquée
dans des conditions stériles. Elle nécessite à la fois la préparation du lit de la lésion et l’application d’une
colle de fibrine sur la base et les bords de la lésion afin de bien fixer l’implant. Quelques sutures
résorbables discontinues peuvent également être faites, à la discrétion du chirurgien, afin d’assurer une
fixation supplémentaire.
L’implantation doit être suivie d’un programme de rééducation adapté (voir rubrique 4.4).
Pour les instructions concernant la préparation et la manipulation de MACI, voir la rubrique 6.6.
4.3 Contre-indications
• Hypersensibilité à l’un des excipients mentionnés à la rubrique 6.1 ou aux produits d’origine porcine
ou à tout composant résiduel issu de la fabrication de MACI, y compris le sérum bovin, et à la
gentamicine.
• Arthrose sévère du genou.
• Arthrite inflammatoire, maladie articulaire inflammatoire ou trouble congénital de la coagulation non
corrigé.
• Patients dont la plaque de croissance épiphysaire fémorale n’est pas complètement fermée.

Marketing Authorisation Suspended
4
4.4 Mises en garde spéciales et précautions d’emploi
Généralités
MACI est un implant autologue et ne doit être administré qu’au patient pour lequel il a été fabriqué.
L’implantation de MACI doit être pratiquée dans des conditions stériles, au cours d’une arthrotomie. Bien
que l’expérience relative à la pose de MACI dans le genou par le biais d’une arthroscopie soit limitée, il
est toutefois possible, à la discrétion du chirurgien, d’utiliser les techniques arthroscopiques afin de poser
MACI.
Précautions d’emploi
Chez les patients atteints d’inflammation locale ou d’infection active de l’os, de l’articulation ou du tissu
mou environnant, l’intervention doit être reportée jusqu’à la guérison, celle-ci doit être documentée.
Dans le cadre de l’étude pivot menée sur MACI, les patients étaient exclus s’ils présentaient des
antécédents d’arthrose dans le genou traité (grade 3 ou 4 sur l’échelle de Kellgren-Lawrence) ou une
maladie inflammatoire concomitante.
Afin de créer un environnement propice à la cicatrisation, les pathologies concomitantes doivent être
traitées avant ou en même temps que l’implantation de MACI. Celles-ci comprennent :
• Les pathologies méniscales : un ménisque instable ou déchiré doit être réparé, remplacé ou subir à
une méniscectomie partielle. MACI n’est pas recommandé chez les patients ayant subi une
méniscectomie totale sauf si la pathologie méniscale peut être traitée grâce à une greffe méniscale
concomitante ou effectuée en plusieurs temps.
• Les instabilités du ligament croisé : l’articulation ne doit présenter aucune laxité excessive. Les
ligaments croisés antérieur et postérieur doivent tous deux être stables ou être soumis à une
reconstruction afin de réduire les forces de cisaillement et la pression exercée par la rotation sur
l’articulation.
• Les défauts d’alignement : l’articulation tibiofémorale doit être correctement alignée. Une
distribution pondérale anormale de l’articulation tibiofémorale en varus ou en valgus peut
compromettre l’implantation et doit être traitée au moyen d’une ostéotomie corrective ou d’une
intervention similaire. Lors du traitement de lésions trochléennes et rotuliennes, tout alignement
rotulien anormal doit être corrigé avant ou en même temps que l’implantation de MACI.
Une hémarthrose postopératoire peut apparaitre principalement chez les patients prédisposés aux
hémorragies ou chez qui le contrôle hémorragique chirurgical est difficile.
Les fonctions hémostatiques du patient doivent être évaluées avant l’intervention chirurgicale. Un
traitement tromboprophylaxique doit être administrée conformément aux recommandations en vigueur.
Il convient de suivre les recommandations en vigeur concernant le recours à une prophylaxie antibiotique
dans le cadre d’une chirurgie orthopédique.
En raison d’une expérience limitée, l’utilisation de MACI dans d’autres articulations que le genou n’est
pas recommandée.
MACI est expédié après la réalisation d’un test de stérilité rapide validé pour contrôler l’absence de toute
croissance microbienne. Les résultats finaux du test de stérilité ne sont pas disponibles au moment de
l’expédition. S’ils s’avèrent être positifs, le médecin traitant sera alors contacté afin de discuter de
l’annulation de l’implantation ou d’un plan d’action en tenant compte de l’état du patient et de
l’évaluation du risque.

Marketing Authorisation Suspended
5
Rééducation
Afin de stimuler la maturation du greffon, de réduire le risque d’événements thrombo-emboliques
postopératoires et de raideur de l’articulation, il est recommandé de mettre en place le plus tôt possible
une kinésithérapie comprenant une mobilisation précoce, des exercices visant à restaurer l’amplitude des
mouvements et une mise en charge partielle.
Après l’implantation, le patient doit suivre un programme de rééducation progressive, contrôlé de manière
appropriée, recommandé par le médecin traitant en s’appuyant sur le manuel de rééducation MACI. Ce
programme doit inclure des exercices physiques spécifiques ou progressifs, afin de réduire au minimum le
risque d’arthrofibrose, ainsi qu’une remise en charge partielle progressive. La reprise d’activités sportives
doit être personnalisée en consultation avec des professionnels de la santé.
Cas dans lesquels MACI ne peut pas être fourni
Dans certains cas, il se peut que les chondrocytes provenant du patient ne soient pas amplifiables ou que
les critères de libération (voir rubrique 6.6) ne soient pas remplis en raison de la qualité médiocre de la
biopsie, des caractéristiques du patient ou d’un défaut de fabrication. Par conséquent, il peut arriver que
MACI ne puisse être délivré.
4.5 Interactions avec d’autres médicaments et autres formes d’interactions
La colle de fibrine contenant du formaldéhyde ne doit pas être utilisée avec MACI dans la mesure où le
formaldéhyde est cytotoxique pour les chondrocytes.
Il est recommandé d’administrer des antalgiques par voie orale afin de soulager les douleurs
postopératoires. L’administration intra-articulaire d’analgésiques n’est, quant à elle, pas recommandée car
des études ont montré des effets indésirables sur le cartilage articulaire et les chondrocytes.
4.6 Fertilité, grossesse et allaitement
Grossesse
Il existe peu de données cliniques sur l’utilisation de MACI pendant la grossesse. Les études classiques
de toxicité sur la reproduction et le développement embryofoetal ne sont pas jugées pertinentes étant
donné la nature et l’utilisation clinique prévue du produit. Compte tenu de la nature et de l’utilisation
localisée de MACI, aucun effet indésirable n’est attendu pendant la grossesse sur le developpement
embryofoetal. Toutefois, MACI étant implanté au moyen de techniques chirurgicales invasives, il n’est
pas recommandé pendant la grossesse.
Allaitement
Il n’existe pas de données sur l’utilisation de MACI pendant l’allaitement. Compte tenu de la nature et de
l’utilisation localisée du produit, aucun effet indésirable associé à MACI n’est attendu chez le nourrisson.
Toutefois, MACI étant implanté au moyen de techniques chirurgicales invasives, une décision doit être
prise concernant l’interruption ou non de l’allaitement en prenant en compte le bénéfice du traitement pour
la femme au regard du risque pour le nourrisson.
Fertilité
Il n’existe pas de données sur les effets éventuels du traitement par MACI sur la fertilité.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
1
/
28
100%