these allotransplantation faciale : analyse de techniques chirurgicales

UNIVERSITE PARIS VI – PIERRE ET MARIE CURIE
U.F.R. DE SAINT-ANTOINE
THESE
Pour obtenir le grade de
DOCTEUR EN MEDECINE
en
CHIRURGIE PLASTIQUE RECONSTRUCTRICE
ET ESTHETIQUE
Présentée et soutenue publiquement le 29 novembre 2004
Par
Eric BOUHANNA
Né le 06 avril 1974 à PARIS
ALLOTRANSPLANTATION FACIALE :
ANALYSE DE TECHNIQUES CHIRURGICALES
Président de thèse : Professeur D. HOUSSIN
Directeur de thèse : Docteur F. PETIT
Membres du jury : Pr L. LANTIERI, Pr F. DISANT,
Dr C. VACHER, Pr D. CHERQUI

1
ALLOTRANSPLANTATION FACIALE : ANALYSE DE
TECHNIQUES CHIRURGICALES
SOMMAIRE

2
I) Introduction……………………………………………………………
II) Historique………………………………………………………………
A) Historique des transplantations d’organes et de tissus composites……………
B) Les premières applications d’allotransplantations
de tissus composites chez l’homme………………………………………
III) Reconstruction faciale - Origine et évolution………………………….….
IV) Projet d’une allogreffe de face…………………………………………..
A) Indications et objectifs…………………………………………………
B) Les difficultés techniques………………………………………………
C) Notre approche…………………………………………………………
V) Matériels et méthodes………………………………………………………
A) Matériels………………………………………………………….……
B) Méthodes……………………………………………………………….
VI) Techniques chirurgicales de l’allotransplantation faciale…………………….
A) Allotransplantation du système palpébral…………………………………
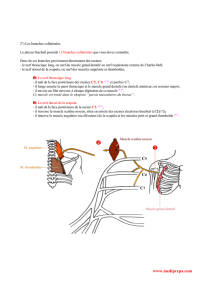
I. Rappel anatomique…………………………………………………
II. Technique de prélèvement du système palpébral ……………………
III. Technique de transplantation du système palpébral……………………
B) Allotransplantation de la partie médiane de la face : complexe nasolabial……
I. Rappel anatomique…………………………………………………
II. Technique de prélèvement du complexe nasolabial…………………
III. Technique de transplantation du complexe nasolabial…………………
C) Allotransplantation du masque facial………………………………………
I. Rappel anatomique…………………………………………………
II. Technique de prélèvement du masque facial…………………………
III. Technique de transplantation du masque facial………………………
D) Allotransplantation du scalp………………………………………………
I. Rappel anatomique…………………………………………………
II. Technique de prélèvement du scalp…………………………………
III. Technique de transplantation du scalp………………………………
4
5
5
7
13
18
18
23
28
31
31
31
32
32
32
39
46
48
48
53
63
65
65
67
73
76
76
78
79

3
E) Technique de réparation du donneur ………………………………………
VII) Discussion…………………………………………………………………
A) Aspect chirurgical…………………………………………………………
I. Réflexions à propos de la technique chirurgicale sur sujets
anatomiques…………………………………………………..
II. Les difficultés prévisibles sur le vivant…………………………………
III. Complications vasculaires…………………………………………….
IV. La récupération nerveuse ……………………………………………
B) Aspects immunologiques……………………………………………………
I. Protocole d’immunosuppression………………………………………
II. Complications des immunosuppresseurs………………………………..
III. Le rejet ……………………………………………………………
C) Aspect éthique…………………………………………………………….
I. Ethique et transplantation - généralités…………………………………
II. Considérations éthiques vis à vis du receveur…………………………..
III. Considérations éthiques vis à vis du donneur et de sa famille………….
IV. Considérations éthiques dans la société………………………………
VIII) Conclusion……………………………………………………………………
80
82
82
82
89
90
90
93
93
93
96
99
99
100
103
105
106

4
I) Introduction
La chirurgie plastique actuelle dispose de nombreuses techniques de reconstruction qui
permettent de traiter les pertes de substance de la face, après traumatismes, cancers ou
malformations. Cependant la complexité des structures superficielles de la face laisse certains
délabrements inaccessibles à tout procédé de reconstruction.
Les progrès récents dans les domaines de la microchirurgie et des traitements
immunosuppresseurs ont fait naître un nouveau concept chirurgical : l’allotransplantation de
tissus composites vascularisés.
La première allogreffe de main réalisée en 1998 par l’équipe du Pr Dubernard ouvre
véritablement la voie de cette pratique chirurgicale.
Les résultats des premières allotransplantations de tissus composites chez l’homme ces six
dernières années sont encourageants et incitent à proposer d’autres applications cliniques.
L’allotransplantation de face, qui jusqu’à ce jour était considérée comme une fiction, pourrait
être la prochaine étape.
Les objectifs de ce travail sont de proposer une technique chirurgicale appliquée à la
transplantation totale ou partielle de la face, d’évaluer la faisabilité, d’envisager les contraintes
de la vascularisation et de la réinnervation des greffons et d’établir une méthode de réparation du
donneur.
En vue d’une application clinique, nous avons évoqué les objectifs de la transplantation de
face avec ses principales indications, les complications chirurgicales et immunologiques et
l’aspect éthique.
Notre étude est fondée sur des dissections de sujets anatomiques réalisées à partir des
connaissances anatomiques, des règles de chirurgie reconstructrice et de l’expérience dans la
littérature.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
1
/
114
100%