Biologie cellulaire

DIPLOME!: L1
ANNEE UNIVERSITAIRE : 2006 - 2007
SESSION : 1
Biologie cellulaire
DATE : 9 / 01 / 2007 DUREE DE L’EPREUVE : 1h30
NOMBRE DE PAGES DU SUJET!: pages
INFORMATIONS!: DOCUMENT(S) AUTORISE(S)!: non
CALCULATRICE AUTORISEE!: non
AUTRES!:
IMPORTANT!: Toutes vos réponses devront être concises et justifiées.
La qualité de la rédaction sera prise en compte.
I - Contrairement à ce que pourrait laisser penser leur nom, les stéréocils de l’oreille
interne ne présentent pas la structure d’un cil. Au contraire, leur structure rappelle celle
d’une microvillosité
a - Quelle est la structure d’un cil!?
b - Quelle est la structure d’une microvillosité!? (un schéma est attendu)
c - Des microfilaments sont plongés dans une solution pure concentrée de dimères de
tubuline. D’après vos connaissances, que se passe-t-il!?
II – Le récepteur à la transferrine
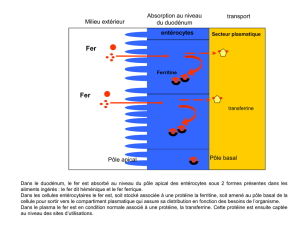
1 – Chez les mammifères, le fer (Fe3+) est transporté jusqu’aux cellules par le sang, sous forme d’un
complexe avec une protéine du plasma!: la transferrine.
A priori, quel type d’interaction permet la formation de ce complexe!?
2 - L’entrée du fer dans les cellules est rendue possible par la présence d’une molécule
membranaire, le récepteur à la transferrine (RT)!; cette molécule est en effet capable d’interagir
avec la transferrine circulante, puis est endocyté par les cellules. Ce récepteur est une protéine de
180 kD, formé de deux sous-unités identiques. On cherche à comprendre comment cette molécule
est située dans la membrane.
a – Faire un schéma légendé du modèle de la membrane plasmique (Singer & Nicholson)
mettant en évidence ses différents constituants.
Par un procédé adéquat (immunoprécipitation), on est capable de purifier le RT à partir de
membranes biologiques traitées avec un détergent.
Des cellules de foie en culture sont capables d’endocyter la transferrine. Par contre, les mêmes
cellules traitées par la trypsine (une grosse enzyme protéolytique) ne fixent plus la transferrine!; la
purification des RT à partir des membranes plasmiques de ces cellules et électrophorèse SDS-
PAGE donne les résultats ci-dessous (pistes 1 à 3).

Dans une seconde expérience, on isole l’appareil de Golgi de cellules non traitées par la trypsine.
Ces appareils de Golgi isolés sont ensuite traités ou non par de la trypsine. L’identification des RT
au niveau de ces appareils de Golgi donne les résultats ci-dessous (piste 4 et 5).
Identification des RT par immunoprécipitation et électrophorèse SDS-PAGE.
Les protéines déposées sur les différentes pistes correspondent aux conditions
suivantes!:
1 – Purification de RT à partir de membranes plasmiques de cellules non
traitées par la trypsine.
2 – Purification de RT à partir de membranes plasmiques de cellules traitées
par la trypsine.
3 – RT purifié, puis traité par la trypsine.
4 – Purification à partir de l’appareil de Golgi de cellules, sans traitement à la
trypsine.
5 – Purification à partir de l’appareil de Golgi de cellules, après traitement à la
trypsine.
Les chiffres situés à coté des pistes donnent le PM (en kDa)
b – Pourquoi obtient-on une bande à 90 kD!?
c – La trypsine est une enzyme protéolytique!: elle hydrolyse la liaison covalente unissant les acides
aminés au sein d’une protéine. Quel est le nom de cette liaison!? Ecrire l’équation de cette
réaction d’hydrolyse entre deux acides aminés de radicaux R1 et R2.
d – Interpréter le résultat de l’action de la trypsine dans la première expérience (pistes 1 à 3).
e – La piste 4 prouve la présence de RT au niveau de l’appareil de Golgi. Cette présence vous
semble-t-elle prévisible!?
f – Interpréter le résultat de l’action de la trypsine dans la deuxième expérience (pistes 4 et 5).
g – Conclusion!: Proposez un schéma le plus précis possible de la molécule RT en place au niveau
de la membrane plasmique.
III – La phosphatase acide
La phosphatase acide (PA) est une enzyme soluble localisée dans la lumière des lysosomes, où elle
représente 20 à 25 % des enzymes lysosomales. D’après ces informations, et par analogie avec vos
connaissances!:
1 - Où la PA peut-elle être assemblée dans la cellule ?
2 - Comment la PA peut-elle atteindre les lysosomes ?
3 - La PA est-elle une protéine non glycosylée, une glycoprotéine, ou un protéoglycane!?
IV – Définir les termes suivants en quelques lignes au maximum!:
- structure secondaire d’une protéine
- phospholipide (donner un exemple)
- jonction étanche
- lame basale
- centriole
- concentration critique
- lamine
- jonction adhérente
- expérience en pulse-chase
- proteoglycane
NB!: Barême indicatif!: I!: 3 points, II!: 9 points, III!: 3 points, IV!: 5 points.
1
/
2
100%