Exercices d'électrolyse - Chimie Terminale STL

Term STL SPCL –Lycée Ste Anne- Verdun B. CHIOMENTO
Chimie et développement
durable
EXERCICES
L’ELECTROLYSE
Des synthèses forcées
EXERCICE 1.L’affinage du cuivre
Le cuivre obtenu à partir de son minerai contient habituellement beaucoup d’impuretés (du zinc, du
fer, de l’argent, de l’or…). Pour le raffiner, on réalise l’électrolyse d’une solution de sulfate de cuivre
acidifiée, en utilisant une cathode en cuivre pur. Cette technique permet d’obtenir du cuivre pur à
99,5 % au moins.
1. Faire le schéma de l’électrolyse.
2. Indiquer toutes les oxydations possibles à l’anode.
3. En réalité, seuls le cuivre, le zinc et le fer sont oxydés, mais les cations du fer et du zinc ne sont pas
réduits à la cathode ; on n’observe aucun dégagement gazeux à cette électrode.
Quelle est l’équation de la réaction correspondant à cette électrolyse ?
4. De quoi sont composées les impuretés récupérées au fond de l’électrolyseur ? Conclure.
EXERCICE 2.L’accumulateur nickel-cadmium
L’accumulateur nickel-cadmium est employé dans de nombreux appareils électriques autonomes. Il
est étanche et plus stable du point de vue chimique qu’une batterie d’accumulateurs au plomb. Il
peut, en outre, rester inemployé durant des périodes prolongées.
Couples rédox : NiO(OH)/Ni(OH)2 et Cd(OH)2/Cd solides ou gélifiés
1. Ecrire les demi-équations électroniques correspondant à ces deux couples.
2. Sachant que du cadmium est reformé durant la charge de cet accumulateur, indiquer les réactions
qui ont lieu au niveau des électrodes.
3. En déduire les équations des réactions lors de la charge, et lors de la décharge.
4. Indiquer la polarité de cet « accu » au cours de sa décharge.
EXERCICE 3.Chromage d’une pièce métallique
Pour chromer une pièce métallique de 20 cm², on réalise l’électrolyse d’une solution contenant des
ions chrome Cr3+(aq). On veut déposer une couche de chrome de 50 μm d’épaisseur.
1. La pièce métallique sert d’électrode dans cette électrolyse. Doit-elle être la cathode ou l’anode ?
Justifier.
2. Calculer la masse de chrome à déposer sur la pièce métallique.
3. En déduire la quantité de matière correspondante.
4. Quelle doit être l’intensité du courant (supposée constante) pour que l’opération se fasse en 10
heures ?
Données : densité du chrome : 7 200 ; masse molaire du chrome : 52 g/mol.
EXERCICE 4.Pile Daniell et électrolyse
On réalise une pile Daniell ; la tension relevée aux bornes de cette pile est de 1,1 V.
1. Rappeler les équations aux électrodes, l’équation de pile et le principe de fonctionnement de cette
pile.
2. Que se passe-t-il si l’on laisse cette pile débiter indéfiniment ?
On intercale maintenant un générateur de tension continue entre les deux électrodes de la pile, la
borne (+) du générateur étant reliée à l’électrode de cuivre.
3. Quelle doit être la fém minimale du générateur ?
4. Identifier les électrodes où se produisent les réactions d’oxydation et de réduction, et écrire les
demi-équations correspondantes.
5. Ecrire l’équation de la réaction associée à la transformation globale.
6. Cette transformation est-elle spontanée ? Justifier.
7. Que se passe-t-il lorsqu’on débranche le générateur et qu’on le remplace par un voltmètre ?
Term STL SPCL –Lycée Ste Anne- Verdun B. CHIOMENTO
EXERCICE 5. Une pile est composée de deux demi-piles reliées par un pont salin (papier filtre
imbibé d’une solution de chlorure de potassium). La première demi-pile est constituée d’une lame
d’aluminium de masse m1 = 1,0 g qui plonge dans 50 mL de solution de sulfate d’aluminium (2Al3+(aq)
+ 3SO42-(aq)) de concentration en ion aluminium [Al3+(aq)] = 5,0.10-1 mol.L-1. La seconde est
constituée d’une lame de cuivre de masse m2 = 8,9 g qui plonge dans 50 mL de solution de sulfate de
cuivre (Cu2+(aq) + SO42-(aq)) de concentration [Cu2+(aq)] = 5,0.10-1 mol.L-1.
On associe à cette pile un ampèremètre et une résistance en série.
1. Réaliser le schéma annoté de la pile.
2. L’ampèremètre indique que le courant circule de la plaque de cuivre vers la plaque d’aluminium à
l’extérieur de la pile. Préciser, en le justifiant, la polarité de la pile. Compléter votre schéma en
indiquant cette polarité.
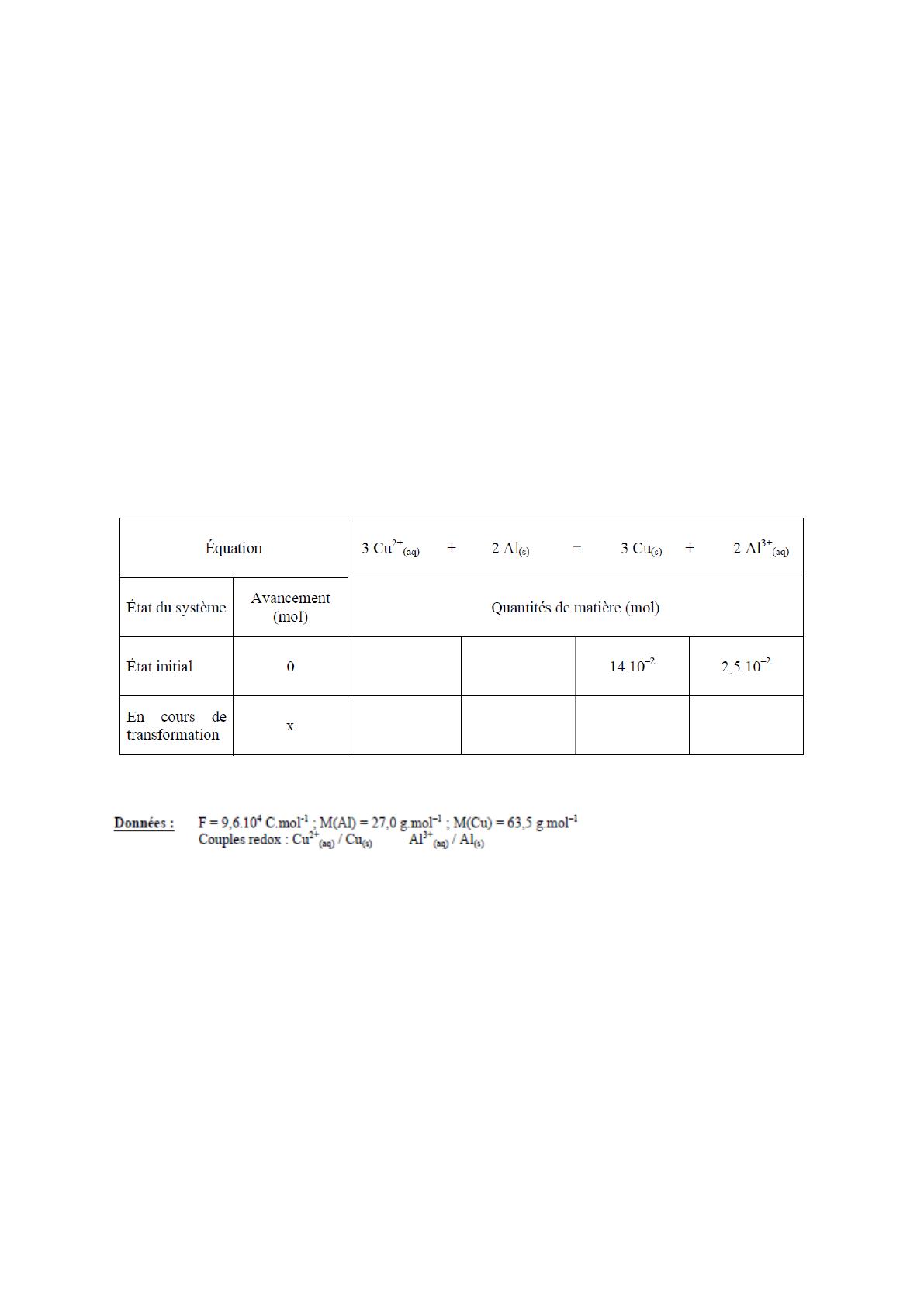
3. L’équation d’oxydoréduction de fonctionnement de la pile est :
3 Cu2+ (aq) + 2Al(s) = 3 Cu(s) + 2 Al3+(aq) (1)
Écrire les équations des réactions se produisant à chaque électrode.
4. La constante d’équilibre associée à l’équation (1) est K = 10200.
4.1. Déterminer le quotient initial de réaction du système ainsi constitué.
4.2. Le sens d’évolution du système étudié est-il cohérent ?
5. Étude de la pile en fonctionnement.
5.1. Déterminer les quantités de matière initiales en moles des réactifs de l’équation chimique (1).
Compléter le tableau descriptif de l’évolution du système. En déduire la valeur de l’avancement
maximal.
5.2. Calculer la quantité maximale d’électricité que peut débiter cette pile.
EXERCICE 6.
Données : masse molaire atomique du cuivre : M(Cu) = 63,5 g.mol-1 ; faraday : 1 faraday = 96500
C.mol-1 ; charge électrique élémentaire : e = 1,602.10–19 C ; constante d'Avogadro : NA = 6,02.102 mol-1.
On considérera que 8,3 .10 -26 = 0.
1. Réaction entre le cuivre métal et le dibrome en solution aqueuse.
Dans un becher, on verse 100 mL de solution aqueuse jaune de dibrome (Br2(aq)) telle que [Br2] =
1,0.10-2 mol.L-1 et on y ajoute, sans variation de volume, de la poudre de cuivre en excès. On place
sous agitation. Après filtration, on observe la disparition de la coloration jaune et on obtient un filtrat
de couleur bleue.
L'équation de l'équation associée à la transformation est : Cu(s) + Br2(aq) = Cu2+(aq) + 2 Br –(aq). La
constante d'équilibre associée à cette réaction est K1 = 1,2 . 1025.
1.1. Donner l’expression du quotient de réaction initial. Calculer sa valeur.
1.2. Dans quel sens le système va-t-il évoluer ? Justifier la réponse.
1.3. La transformation est-elle forcée ou spontanée ?
Term STL SPCL –Lycée Ste Anne- Verdun B. CHIOMENTO
2. La solution aqueuse de bromure de cuivre (II).
Dans un becher, on verse 100 mL d'une solution aqueuse de bromure de cuivre (II). Les concentrations
des ions en solution sont : [Cu2+(aq)] = 0,50 mol.L-1 et [Br- (aq)] =1,0 mol.L-1 .
Au sein de cette solution, on pourrait envisager une réaction entre les ions Cu2+(aq) et Br - (aq).
L'équation de cette réaction serait : Cu2+(aq) + 2 Br – (aq) = Cu(s) + Br2(aq). La constante d'équilibre
associée à cette réaction est K2= 8,3 . 10-26.
2.1. Calculer la valeur du quotient de réaction initial.
2.2. Quelle sera la valeur de ce quotient à l'équilibre ?
2.3. Justifier l'affirmation "la solution aqueuse de bromure de cuivre (II) est stable".
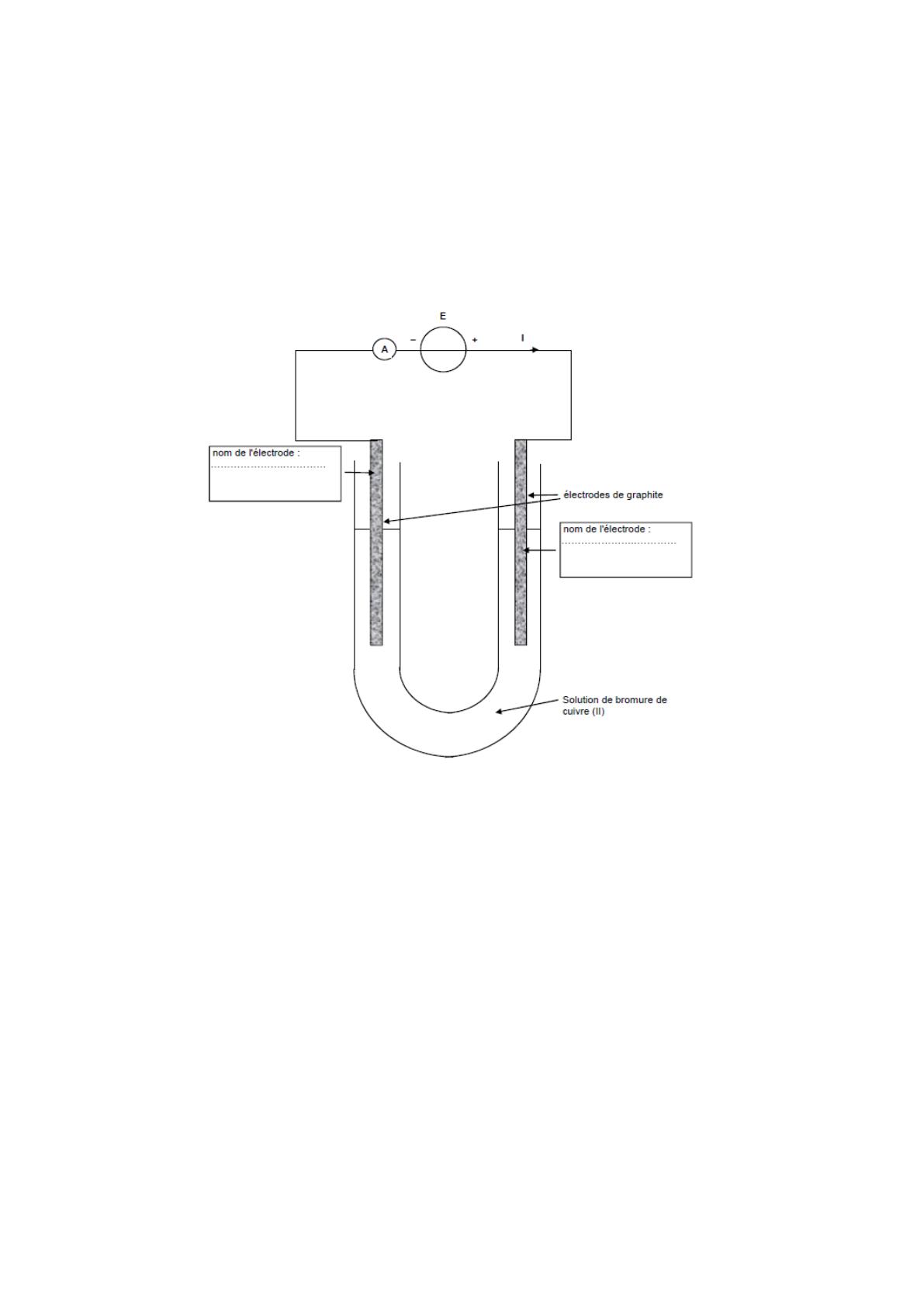
3. Électrolyse de la solution aqueuse de bromure de cuivre (II).
Pour conduire cette électrolyse, on réalise le montage représenté ci-dessous :
3.1. Étude qualitative.
Sur le schéma du montage est indiqué le sens conventionnel du courant électrique imposé par le
générateur.
3.1.1. Identifier l'anode et la cathode.
3.1.2. Écrire la demi- équation de la réaction qui a lieu à l'anode.
3.1.3. Écrire la demi- équation de la réaction qui a lieu à la cathode.
3.1.4. Écrire l'équation de la réaction d’électrolyse.
3.1.5. La transformation associée à la réaction d'électrolyse est-elle spontanée ou forcée? Aucune
justification n'est demandée.
3.2. Étude quantitative.
L'électrolyse est effectuée pendant 1 heure avec une intensité constante I = 1,00 A.
Calculer :
3.2.1. La quantité d'électricité Q qui a traversé la solution de bromure de cuivre (II).
3.2.2. La quantité de matière (en mol) d'électrons qui a été mise en jeu.
3.2.3. La quantité de matière (en mol) de cuivre qui s’est formée. On pourra s’aider d'un tableau
d’évolution du système.
3.2.4. La masse de cuivre obtenue.
1
/
3
100%









