immunité anti-virale 2

1
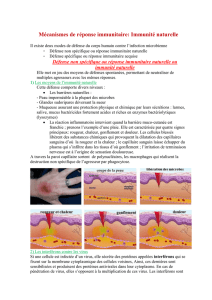
IMMUNITE ANTI-VIRALE
Réceptivité
(Hôte normal)
Maladie infectieuse
Sensibilité
(hôte débilité)
Espèce
Race
Age Individu
Mode de pénétration
Immunodéficiences
acquises
Infections intercurrentes
(synergie entre
microorganismes)
Lésions
(peau,
muqueuses)
Stress
Carences
POUVOIR PATHOGÈNE
Pathogénie de l’infection virale
Entrée dans la cellule*
Libération du virus*
Décapsidation*
Réplication*
Assemblage viral*
Libération du virus* ECP
Protéines virales*Latence
* Étapes cibles de la réponse immune
•Immunité protectrice
Immunité non spécifique
Immunité spécifique
•Effets délétères de la réponse anti-virale
•Mécanismes d’échappement à la réponse immunitaire
Immunité anti-virale

2
Immunité non spécifique
•Défenses non immunologiques
Mécaniques
Chimiques
•La fièvre
•Le complément
•Les cellules phagocytaires
•Les Interférons de type I
Immunité non spécifique
•Le complément
Ag Reconnaissance directe
Reconnaissance AC+Ag
Activation
du 2ème élément
Activation
du 3ème élément
Activation
du dernier élément
Chimiotactisme
Lyse cellulaire
Opsonisation
Immunité non spécifique
•Les cellules phagocytaires
1: phagocytose
2: activation 3: Recrutement des macrophages
et des cellules dendritiques
Cytokines
Chémokines
Ag
Les INTERFERONS
•Les INTERFERON de type I: Immunité non spécifique
IFNα: 14 sous types chez l’homme
IFNβ:
IFNλ:
IFNω:
IFNτ: Immunité placentaire
•L’INTERFERON de type II: Immunité spécifique
Un seul représentant: IFNγ
Produit par les lymphocytes T activés Th-1 et les NK
Induit la réponse à médiation cellulaire
Réponse T cytotoxique
Production AC IgG2a

3
La cascade d’activation des IFN-I suite à une infection virale
•IFNα et IFNβ: produits par presque toutes les cellules de l’organisme suite à une
infection virale.
•Stimuli activateurs:
Virus attaché à la surface cellulaire
ARN simple brin intracellulaire
ARN double brin intracellulaire
Réponse quasi instantanée
IFN-I
Cellule infectée
PROTEINES ANTI-VIRALES
IFN
Cellule infectée
IFN R
Effet autocrine
•Nature du récepteur: IFN-AR, commun à tous les IFN-I
Mais zone de reconnaissance et affinité différente selon les IFN
Effets différents selon les IFN et selon les cellules
•Déclenchement d’une cascade d’activation intra-cellulaire (300 gènes activés)
Blocage de la production protéique (traduction: Mx)
Blocage des polymérases virales
Activation d’Ez dégradant les ARN ou bloquant la transcription
Suicide de la cellule infectée (apoptose)
Cellule infectée devient réfractaire à la multiplication virale
Acquisition d’une résistance à la multiplication virale
(mais uniquement lorsque la cellule est au contact du virus: 2 signaux nécessaires)
Mécanisme identique à celui des cellules productrices
Déclenchement d’un suicide de la cellule infectée (Apoptose)
Augmentation de l’expression des CMH-I
Présentation des Ag viraux: alerte du SI
•Action à distance sur les cellules environnantes
Cellules n’appartenant pas au SI
Cellules du SI
ADN
IFN R
PROTECTION
PROTEINES ANTI-VIRALES
2 signaux
Effet paracrine
•Sur les cellules n’appartenant pas au SI
Rôle des IFN-I dans l’induction de la réponse
immunitaire spécifique
IFNβ induit la maturation des cellules dendritiques (DC)
DC indispensables à l’induction de la réponse immunitaire spécifique
C dendritiques
Noeud lymphatique
LB
LT CD8
MIGRATION
Activation LT CD4
LT CD4
Ag
IL-12

4
Le système de reconnaissance des micro-organismes par les
cellules présentatrices de l’Ag:
Les Toll like receptors
•TLR: -Protéines spécialisées dans la reconnaissance de
molécules exprimées par les micro-organismes.
-Localisation cellulaire en fonction du ligand reconnu
-Expression majoritaire sur les CPA
•Ligands (PAMP): -Lipides, protéines, acides nucléiques conservés entre
les différents micro-organismes: faible variabilité
-En principe différents des molécules du soi
-Ne sont jamais des toxines
TLR1 TLR2-6 TLR4 TLR5 TLR3-7-8-9 TLR11 TLR9
LipoP
P virales (herpes)
LipoP (gram+)
Mycoplasmes
Mycobactéries
Levures LPS
Flagelline
Ac nucléiques
ssRNA
dsRNA
CpG DNA P toxo
ADN bact,
virus,
protozoaires
Les TLR et leurs ligands
Rôle des TLR
•Interaction TLR-ligand induit:
Une réponse différente en fct du ligand et du TLR
En fct de la cellule exprimant le TLR
Participe à la réponse innée inflammatoire: IL1, IL-6, TNFα
Oriente la réponse adaptative Th1/Th2
Les TLR permettent au système immunitaire d’identifier la nature du
micro-organisme présent
•Production 1000 fois supérieure à celle des fibroblastes
DC
IFN-I
TLR
PAMP viraux
Rôle des TLR dans la production d’IFN-I par les DC

5
Immunité spécifique
•Mise en place
•Réponse à médiation humorale
•Cytotoxicité cellulaire
•La mémoire immunitaire
Mise en place immunité anti-virale
Virus libre
Cellule infectée
CTL
TH-1
IL-2 IFNγ
Activation
C dendritiques
Macrophages
Noeud lymphatique
LB
LT CD8
MIGRATION
Activation LT CD4
Expansion clonale
Plasmocyte
LT CD4
Afflux sur le site de l’infection
Retour sur le
site
de l’infection
Immunité spécifique anti-virale
Voie alterne du
complément Neutralisation virale
par les AC
Voie classique du
complément
Amélioration de la phagocytose
Par les macrophages
VIRUS LIBRE
CELLULE INFECTEE
NK Lyse
CMH-I
+peptide viral
AC+ complément
Lyse
Phagocytose par
les macrophages CTL
Lyse
TH-1
IL-2 IFNγ
Activation
Inhibition réplication virale
(signalisation)
Inhibition libération virale
L’attaque des CTL
1
2
3
4
56
1- Adhésion CTL-cellules
2- Reconnaissance TCR-CMH-I+peptide
3-Activation-attaque de la cible
4-Dissociation complexe cible-CTL
5-Destruction de la cible
6-Recirculation/recherche nouvelles cibles
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%