Lire l`article complet

l est clair que le cerveau analyse l’information dans le but de
catégoriser, de modéliser et de réagir à son environnement.
Moins claire est la structure fonctionnelle (computational
armamentarium) qui permet cette intégration. Néanmoins, le
vocabulaire utilisé pour décrire le processus de calcul (comment
l’information est représentée et quelles opérations sont effec-
tuées) doit être compatible avec les mécanismes du calcul et
devient par conséquent contraint par ceux-ci (les détails biophy-
siques du support neuronal). Il est donc important de décrire les
mécanismes biophysiques utilisés par le cerveau pour analyser
l’information. Cette information est essentielle pour interpréter
les “circuits” physiologiques décrits par les anatomistes. Elle
nous aide à comprendre les algorithmes utilisés par le système
nerveux, en particulier ceux mis en jeu dans l’apprentissage et le
comportement.
Un problème classique des neurosciences “computationnelles”
concerne la sélectivité à la direction dans la rétine (DS), où se
trouvent des neurones répondant plus fortement à des stimuli se
déplaçant dans une direction (PREF) qu’à d’autres se déplaçant
dans la direction opposée (NULL). La membrane sensorielle de
l’œil est un modèle intéressant en raison de sa localisation phy-
sique périphérique et de son rôle physiologique central.
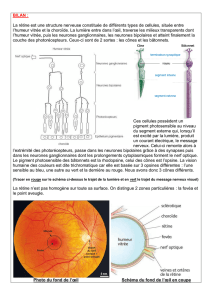
La rétine des vertébrés est organisée en plusieurs couches de
corps cellulaires et leurs dendrites et axones agissent les uns sur
les autres. Le flux du signal est à chaque niveau à la fois direct
(perpendiculaire à l’image) et latéral (parallèle à l’image). La
lumière est transmise au niveau de la couche des photorécepteurs
qui projettent vers les cellules bipolaires et horizontales de la
couche plexiforme externe. Les cellules bipolaires projettent vers
le réseau des dendrites des cellules amacrines et ganglionnaires
dans la couche plexiforme interne. Finalement, les axones des
cellules ganglionnaires forment le nerf optique. Chacune des
catégories principales de cellules de la rétine est organisée en
sous-catégories, sur la base de critères anatomiques, neurochi-
miques (par exemple neurones cholinergiques ou GABAergiques),
ou physiologiques (par exemple, on/off,DS,red/green opponent).
Trois principales combinaisons d’entrées synaptiques sur un
neurone peuvent produire une réponse sélective à la direction
(figure 1). Une conception simple des cellules ganglionnaires DS
implique que la sélectivité apparaisse au niveau de cette cellule
(modèle postsynaptique) ou soit déjà présente au niveau des
entrées de cette cellule (modèle présynaptique). Le modèle post-
synaptique nécessite au minimum une interaction avec un délai
entre des entrées séparées spatialement, et la démonstration phar-
macologique du rôle fondamental de l’inhibition par le GABAA
qui suggère que cette interaction a lieu entre les entrées excita-
trices et inhibitrices. Par conséquent, l’asymétrie spatiale et
temporelle des entrées est telle que, pour les mouvements dans
la direction NULL, l’excitation et l’inhibition arrivent de manière
synchrone, s’annulant l’une l’autre (1). Pour la direction PREF,
l’excitation n’arrive pas en même temps que l’inhibition, autori-
sant un potentiel postsynaptique excitateur au-dessus du seuil.
Un aspect important de ce mécanisme est que la sélectivité à la
direction est mise en place au niveau de la cellule ganglionnaire :
ni l’excitation, ni l’inhibition ne doivent elles-mêmes dépendre
de la direction du stimulus.
Il existe deux versions du modèle présynaptique. Soit l’excitation
n’est pas sélective à la direction et l’inhibition est plus forte pour
la direction NULL (inhibitory-NULL model),soit l’inhibition
n’est pas sélective à la direction et l’excitation est plus forte pour
la direction PREF (excitatory-PREF model). Dans les deux cas,
la sélectivité à la direction est mise en place avant la cellule gan-
glionnaire.
Les questions auxquelles nous voulons répondre sont donc:
– Quelles sont l’anatomie et la connectivité de la voie DS ?
– Quelle est la non-linéarité cruciale dans la voie DS?
– Où se trouve cette non-linéarité dans la voie DS, est-elle
présynaptique ou postsynaptique ?
Le fait que l’inhibition au GABAAopère d’abord en “shuntant”
la résistance membranaire (2) facilite des prédictions expéri-
mentales permettant de distinguer les signatures biophysiques du
modèle postsynaptique et des deux modèles présynaptiques. Ces
prédictions peuvent être traduites en termes de modulation de la
conductance d’entrée globale de la cellule ganglionnaire, et des
* Unité de neurosciences intégratives et computationnelles, institut de neuro-
biologie Alfred-Fessard, CNRS, Gif-sur-Yvette.
Les circuits et les mécanismes du calcul
de la direction dans la rétine
●L.J. Graham*
I
Figure 1.
Modèle postsynaptique Inhibitory-NULL
Modèle présynaptique Excitatory-PREF
Modèle présynaptique
DÉCOUVERTES
La Lettre du Neurologue - n° 1 - vol. VII - janvier 2003
16

composantes excitatrices et inhibitrices de cette conductance,
pour les réponses PREF et NULL. Mes travaux sur la rétine de
tortue ont donc été conçus pour préciser la connectivité à l’ori-
gine des réponses DS des cellules ganglionnaires. Ces travaux
s’appuient sur des mesures en voltage imposé au niveau des
entrées excitatrices et inhibitrices, une méthode que nous avons
aussi appliquée à l’analyse des réponses fonctionnelles dans le
cortex visuel in vivo (3). Pour résumer, le résultat le plus important
concerne le fait que l’entrée excitatrice sur les cellules ganglion-
naires en réponse au mouvement est systématiquement plus
grande pour le stimulus préféré. Cela caractérise un modèle du
type excitatory PREF model, et va à l’encontre d’un calcul de la
DS au niveau des dendrites des cellules ganglionnaires.
Cependant, l’histoire n’est pas aussi simple : plus récemment, en
utilisant une technique similaire, Taylor et Vaney (4) ont montré
que dans la rétine du lapin (qui a comme celle de la tortue un
pourcentage élevé de cellules ganglionnaires DS), pour certains
neurones, la sélectivité à la direction semble avoir la même ori-
gine que chez la tortue (excitatory-PREF model),alors que pour
d’autres, l’entrée inhibitory-NULL presynaptic DS est dominante,
tandis que chez d’autres encore, une interaction postsynaptique
entre excitation et inhibition a été observée.
Cependant, le traitement présynaptique de la DS apparaît suffi-
sant dans de nombreux cas. Nous avons proposé un modèle de
connectivité (5) centré sur l’intégration synaptique dans les den-
drites, en particulier (mais pas exclusivement) ceux des cellules
cholinergiques starburst amacrines (figure 2). Malgré leur symé-
trie radiale, ce type de cellules représente un candidat potentiel
dans la DS, parce que la DS est fortement dépendante de la voie
cholinergique, et que ces cellules apparaissent étroitement liées
aux cellules ganglionnaires DS. En particulier, le modèle prédit
que les récepteurs GABAAimportants pour la DS sont situés sur
les dendrites de ces cellules, et s’appuie sur les capacités de
shunts des récepteurs au GABAApour fournir la non-linéarité
nécessaire au calcul de la DS. Des résultats récents de Denk et
al. (2002), fondés sur l’imagerie du calcium dans les cellules
starburst amacrines, semblent conforter ce modèle, montrant
qu’en effet les réponses aux sommets des dendrites à des stimuli
en mouvement sont DS.
Que nous dit ce modèle sur le traitement de l’information dans
les neurones en général, en particulier dans le cortex ? Considé-
rons la cascade d’entrées le long d’un dendrite d’un neurone cen-
tral générique. La performance du modèle de la DS rétinienne
suggère qu’une directionalité similaire peut exister pour des neu-
rones non rétiniens, au niveau des afférences le long de chaque
branche. Nous suggérons qu’avec des paramètres biophysiques
plausibles, le soma d’une cellule plus générale verra une réponse
directionnelle venant de ces entrées synaptiques sur la branche
dendritique. Spécifiquement, pour un ensemble donné d’entrées
au cours du temps le long d’une branche dendritique, la réponse
synaptique au niveau du soma sera maximale quand la séquence
des entrées se fera du distal vers le proximal, après le travail clas-
sique de Wilifred Rall. À l’opposé, si le même ensemble d’entrées
est inversé dans le temps, il sera probablement beaucoup moins
efficace pour dépolariser le soma. Comme dans le cas de la DS
rétinienne, le résultat net serait que les branches dendritiques
fonctionneraient autrement que comme de simples intégrateurs
d’entrées indépendants du temps. Ces branches seraient en fait
des filtres spatio-temporels non linéaires.
En conclusion, il faut rappeler que pour le traitement de l’infor-
mation, les neurones rétiniens présynaptiques aux cellules gan-
glionnaires ne communiquent pas en général via des potentiels
d’action. Par conséquent, la découverte que la DS survient avant
la cellule ganglionnaire par une opération fonctionnelle non
linéaire ne nécessitant pas la génération d’un potentiel d’action.
Ces résultats ont des implications particulières pour les réseaux
de neurones de type “connectiviste”, habituellement fondés sur
le seuil de génération du potentiel d’action comme unique élé-
ment non linéaire. ■
Je remercie Manuel Levy pour la traduction française du texte
original.
RÉFÉRENCES BIBLIOGRAPHIQUES
1.
Poggio T, Reichardt W. Considerations on models of movement detection.
Kybernetik 1973 ; 13 (4) : 223-7.
2.
Torre V, Poggio T. A synaptic mechanism possibly underlying directional selec-
tivity to motion. Proceedings of the Royal Society of London 1978 ; 202 : 409-16.
3.
Borg-Graham L, Monier C, Fregnac Y. Visual input evokes transient and strong
shunting inhibition in visual cortical neurons. Nature 1998 ; 389 : 369-73.
4.
Taylor WR, Vaney DI. Diverse synaptic mechanisms generate direction selecti-
vity in the rabbit retina. J Neurosci 2002 ; 22 (17) : 7712-20.
5.
Borg-Graham L, Grzywacz NM. A Model of the direction selectivity circuit in
retina : Transformations by neurons singly and in concert. In: McKenna T, Davis
J, Zornetzer SF (ed). Single Neuron Computation. Academic Press, 1992 : 347-76.
■
Euler T, Detwiler PB, Denk W. Directionally selective calcium signals in
dendrites of starburst amacrine cells. Nature 2002; 418 (6900) : 845-52.
Figure 2.
Borg-Graham LJ.The computation of directional selectivity in the retina occurs presynaptic to the ganglion cell. Nat Neurosci 2001 ; 4 (2) : 176-83.
Découvertes
Découvertes
La Lettre du Neurologue - n° 1 - vol. VII - janvier 2003 17
1
/
2
100%