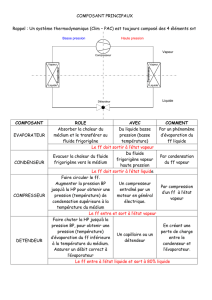
thermodynamique

ii

Table des matières
6 Les fluides réels 1
6.1 Les gaz réels ............................ 1
6.1.1 Allure du réseau des isothermes ............. 1
6.1.2 Équations d’état ..................... 1
6.2 Changements d’état ........................ 2
6.2.1 Liquéfaction des gaz ................... 2
6.2.2 Courbe de pression de vapeur .............. 3
6.2.3 Chaleur latente de vaporisation ............. 4
6.2.4 Formule de Clapeyron .................. 4
6.2.5 Titre de vapeur ...................... 4
6.3 Diagrammes thermodynamiques ................ 5
6.3.1 Les tables de vapeur ................... 9
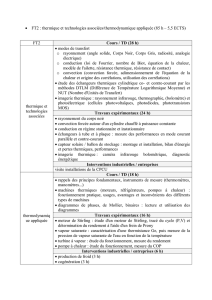
7 turbine à vapeur : 11
7.1 Introduction ............................ 11
7.1.1 Les installations industrielles à vapeur ......... 11
7.1.2 Calculs d’énergie ..................... 14
7.1.3 Cycle de Hirn (Surchauffe de la vapeur) ........ 15
7.1.4 Détente étagée (cycle avec resurchauffeur) ....... 17
7.1.5 Turbine à contre-pression ................. 19
7.1.6 Cycle à soutirage (ou à prélèvement) .......... 19
8 Transferts thermiques 23
8.1 Introduction. ........................... 23
8.1.1 Flux de chaleur ...................... 23
8.1.2 Trois modes de transfert : ................ 25
8.2 Conduction en régime permanent ................ 26
8.2.1 Conduction à travers une paroi plane en régime per-
manent. .......................... 26
8.2.2 Régime permanent. .................... 29
8.2.3 Interface avec un fluide : loi de Newton ......... 29
iii

iv TABLE DES MATIÈRES
8.3 Notion de résistance thermique ................. 31
8.3.1 Géométrie plane mur composite ............. 31
8.3.2 Géométrie cylindrique .................. 33
8.3.3 Géométrie sphérique ................... 34
8.3.4 Résistances en parallèle .................. 35
8.3.5 Coefficients de transferts globaux ............ 36
8.4 Analogie électrique ........................ 36

Chapitre 6
Les fluides réels
6.1 Les gaz réels
6.1.1 Allure du réseau des isothermes
La loi des gaz parfaits est une loi approchée qui ne représente correctement
le comportement des gaz qu’aux faibles pressions.
Dans un diagramme d’Amagat (P V, P )les isothermes d’un gaz parfait
sont des droites horizontales.
Figure 6.1 – Réseau des isothermes
d’un gaz parfait dans le diagramme
d’Amagat
Les mesures effectuées sur les gaz
réels permettent de tracer le réseau
des isothermes des gaz réels, par
exemple ici l’azote.
Vers les basses températures, les
courbes se déforment jusqu’à pré-
senter un point d’inflexion. L’iso-
therme correspondante est appelée
isotherme critique. En dessous de
cette température (-147 °C pour
l’azote), le gaz peut être liquéfié.
La température pour laquelle la
pente de l’isotherme aux basses pres-
sions est nulle est appelée tempé-
rature de Mariotte (50 °C pour
l’azote).
6.1.2 Équations d’état
1
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
1
/
41
100%