15 t3 act 1 cycle de vie du zinc

THEME 1 : LES MATERIAUX CHAP.1 CYCLE DE VIE DES MATERIAUX (CHAP.7 DU LIVRE)
Ch1 – Act.1 Cycle de vie du zinc - 1/2
Mots-clés : élaboration, cycle de vie, recyclage, corrosion
ACT. 1 : ASDS ET RPB : CYCLE DE VIE DU ZINC
La métallurgie désigne l’ensemble des procédés permettant l’élaboration d’un métal à partir de son minerai.
L’hydrométallurgie s’effectue en solution aqueuse.
ASDS : Comment obtenir du zinc pur à partir de son minerai ? (Compétence APP)
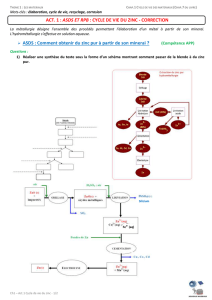
Document n°1 : Hydrométallurgie du zinc
Le minerai de zinc le plus couramment utilisé contient des substances terreuses (la gangue)
associées à un mélange d’oxydes et de sulfures métalliques : la blende (elle contient 40 à 60 % de sulfure
de zinc (ZnS) mais aussi FeS, PbS, CuO et SiO2 notamment).
Le zinc est élaboré à partir de son minerai par hydrométallurgie selon les étapes suivantes :
- Séparation de la gangue et de la blende.
- Grillage de la blende dans un four, avec de l’air, pour former la calcine, c’est-à-dire un mélange
d’oxydes (ZnO, PbO, CuO, SiO2) et du sulfate de fer III Fe2(SO4)3 .
- Lixiviation : « dissolution » de la calcine dans de l’acide sulfurique liquide concentré.
- Le plomb et le silicium restent à l’état solide : on les élimine par filtration... Les autres métaux se retrouvent en solution sous
forme d’ions
2
(aq)
Zn
,
2
(aq)
Cu
et
2
(aq)
Fe
.
- Le milieu est rendu oxydant par injection de dioxygène afin d’oxyder les ions fer II (
2
(aq)
Fe
) se trouvant dans la solution en
ions fer III (
3
(aq)
Fe
).
- En ajustant le pH de cette solution avec du sulfate d’ammonium, les ions
3
(aq)
Fe
précipitent sous forme d’un solide brun de
formule Fe6(OH)12(SO4)4(NH4)2(s), qui est ensuite éliminé par filtration.
- Un dernier traitement, la cémentation, consiste à faire réagir les ions
2
(aq)
Cu
avec de la poudre de zinc : des ions
2
(aq)
Zn
sont
formés, ainsi que du cuivre solide qu’il suffit d’éliminer.
- Le zinc pur est finalement obtenu par électrolyse de la solution contenant les ions
2
(aq)
Zn
.
Questions :
1) Réaliser une synthèse du texte sous la forme d’un schéma montrant comment passer de la blende à du zinc
pur.
2) On dit que la métallurgie est une succession d’étapes de séparation. Justifier cette affirmation.
3) Retour sur les étapes d’oxydation
a) Le minerai contenant l’oxyde de zinc est attaqué pendant plusieurs heures et à la température de 60°C par une
solution aqueuse d’acide sulfurique à 2 mol / L. 80 à 90 % de l’élément zinc se transforme alors en ions zinc (II). Ecrire
l’équation de la réaction de cette lixiviation acide, sachant qu’il se forme aussi de l’eau.
b) Ecrire l’équation de la réaction d’oxydoréduction qui a permis l’oxydation des ions fer II en ions fer III sachant
que les couples sont :
3
(aq)
Fe
/
2
(aq)
Fe
; O2 (g) / H2O (aq).
Des utilisations courantes du zinc :
La galvanisation de pièces en acier (Compétence ANA)
La galvanostégie est un procédé électrochimique visant à déposer une couche de
métal sur un objet. Dans le cas d’un dépôt de zinc, on parle de galvanisation. Ainsi,
40 % de la production française de zinc est utilisée pour lutter contre la corrosion des
pièces en acier (pièces essentiellement constituées de fer et donc soumises à la
formation de rouille).

THEME 1 : LES MATERIAUX CHAP.1 : CYCLE DE VIE DES MATERIAUX
Ch1 –Act 1 : Cycle de vie du zinc - 2/2
Le dépôt protecteur de zinc s’effectue par électrolyse :
- La cathode est constituée de l’objet à recouvrir
- L’anode est souvent constituée du métal que l’on veut déposer (ici Zn(s))
- Ces deux électrodes plongent dans un bain contenant le cation du métal à déposer, ici les ions Zn(aq)
2+ du métal Zn(s)
- Elles sont reliées par un générateur de tension continue.
Lors de l’électrolyse, il s’établit un courant au niveau de la surface S de l’objet à protéger.
Question : Dans le cas de la galvanisation d’une plaque d’acier, faire un schéma légendé de l’électrolyse qui a lieu : on
indiquera le sens de circulation des électrons, du courant, la polarité du générateur, ainsi que l’anode et la cathode.
Rappel : Lors d’une réaction d’oxydoréduction, l’oxydation se fait sur l’anode, la réduction sur la cathode.
Les anodes sacrificielles (Compétences ANA et REA)
Voir activité 3 - RPB Comment protéger la coque d’un bateau de la corrosion ?
Complément : Le recyclage du zinc :
Le recyclage du zinc est techniquement possible à 100 % et la filière de récupération est très bien organisée. A l'heure actuelle,
environ 30 % de la consommation mondiale de zinc provient de zinc recyclé, récupéré des résidus de galvanisation (poussières et
cendres des fours) et des anciens matériels. Le zinc recyclé ne perd aucune de ses propriétés physiques ou chimiques ; il constitue
donc une ressource durable pour les générations futures.
Anode sacrificielle
1
/
2
100%