revue - John Libbey Eurotext

Origine du VIH, une réussite émergentielle
Lucie Etienne
Martine Peeters
Institut de recherche
pour le développement (IRD), UMR145,
Université de Montpellier-I,
911, avenue Agropolis, BP 64501,
34394 Montpellier cedex 05,
France
Résumé. Les virus de l’immunodéficience humaine (VIH) sont le résultat de
multiples transmissions de lentivirus du singe à l’Homme. Au moins quatre
franchissements de la barrière d’espèce des SIV (simian immunodeficiency
virus) des chimpanzés et gorilles d’Afrique équatoriale de l’Ouest sont à
l’origine du VIH-1, et au moins huit transmissions indépendantes des SIV
des mangabeys enfumés d’Afrique de l’Ouest sont à l’origine du VIH-2.
L’ensemble des VIH n’ont cependant pas tous eu la même histoire virologique
et épidémiologique. Certains sont restés restreints à quelques cas d’infections
humaines, alors que d’autres ont connu une propagation à l’échelle mondiale
comme le VIH-1 groupe M, découvert en 1983, et dont la pandémie touche
aujourd’hui plus de 33 millions de personnes. Le risque de nouvelles émergen-
ces zoonotiques de tels lentivirus est à considérer compte tenu des infections
SIV chez de nombreux primates, des prévalences élevées chez certaines espèces,
des contacts hommes-singes toujours fréquents via la chasse et la préparation
de viande de brousse, ainsi que des évolutions sociologiques, économiques,
et démographiques favorisant l’expansion mondiale d’une infection virale.
Mots clés
:
VIH, SIV, émergence, origine
Abstract. Human immunodeficiency viruses (HIV) are the result of multiple
viral cross-species transmissions from non-human primates to humans. SIVs
from chimpanzees and gorillas from west central Africa have crossed the
species barrier on at least four occasions leading to HIV-1 in humans. HIV-2
viruses result from at least eight independent transmissions of SIVs infecting
sooty mangabeys from West Africa. These HIV variants have different virolo-
gical and epidemiological histories. Some have remained restricted to a few
cases of human infections, while others have spread worldwide, like HIV-1
group M affecting today more than 33 million people. Zoonotic emergence
of new lentiviruses has to be considered given the prevalence of SIVs in some
primate species, the increased contact between humans and wild primates
through hunting and bushmeat preparation, and the socio-economic and demo-
graphic factors predisposing global expansion of viral infections.
Key words
:
HIV, SIV, emergence, origin
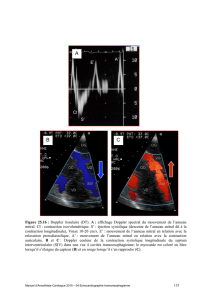
Découverte et histoire du virus du sida
En 1981, le CDC d’Atlanta identifia plusieurs hommes
homosexuels à New York, Los Angeles, ou San Francisco,
atteints de pneumonies à Pneumocystiis carinii et/ou de
sarcomes de Kaposi (CDC 1981) (figure 1). Cette décou-
verte laissait présager l’apparition d’un nouveau type
d’immunodéficience qui fut appelé, en 1982, « syndrome
d’immunodéficience acquise » (sida) et qui semblait
induit par un agent infectieux encore inconnu (CDC
1982). Ces mêmes symptômes ont ensuite été observés
chez des toxicomanes, des patients hémophiles, des Haï-
tiens et chez des Africains vivant en Europe. En mai 1983,
Barré-Sinoussi et al. identifièrent l’agent étiologique du
sida [1], qui fut appelé par la suite virus de l’immunodé-
ficience humaine (VIH). Dès 1984, les premiers cas de
sida en Afrique subsaharienne chez des hommes et des
femmes hétérosexuels furent rapportés [2-4]. À la fin des
Virologie 2010, 14 (3) : 171-84
doi: 10.1684/vir.2010.0307
Tirés à part : M. Peeters
revue
Virologie, Vol. 14, n
o
3, mai-juin 2010 171
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

années 1980, on observait une explosion de l’épidémie en
Afrique, où la prévalence chez les femmes enceintes excé-
dait 25 % dans certaines grandes villes d’Afrique de l’Est et
du Sud [5].
Les recherches d’épidémiologie moléculaire ont par la
suite montré que l’épidémie de sida a pour épicentre
la République démocratique du Congo (RDC), région où
la diversité des variants viraux est la plus grande [6, 7], puis
que le virus a circulé en Afrique Centrale [8], et a ensuite
été introduit en Haïti dans les années 1960 (most recent
common ancestor MRCA 1966), avant sa circulation en
Amérique du Nord (MRCA 1969), environ 12 ans avant
la découverte et la description des premiers cas de sida
[9]. Aujourd’hui, plus de 33 millions de personnes sont
infectées par le virus responsable du sida dans le monde
(figure 1), parmi lesquelles plus de 70 % vivent en Afrique
subsaharienne (UNAIDS 2008). D’ores et déjà plus de
25 millions de personnes sont mortes du sida, et cette
maladie virale continue au XXI
e
siècle d’être l’une des
premières causes de mortalité dans les pays du Sud
(UNAIDS/WHO 2009).
Le VIH est proche des virus SIV
retrouvés chez les primates non humains
Le VIH-1 a été identifié pour la première fois en 1983. En
1986, c’est un autre virus proche du VIH-1, appelé le VIH
de type 2, qui fut décrit chez des patients vivant en France
mais originaires d’Afrique de l’Ouest [10].
Les VIH-1 et VIH-2 sont apparentés aux lentivirus de
primates appelés SIV pour simian immunodeficiency virus.
Peu de temps après la découverte en 1983 du VIH-1, le
premier SIV, SIVmac, fut isolé d’un macaque rhésus
(Macaca mulatta), dans le centre de primatologie du
“New England Regional Primate Research Center”
(NERPRC) aux États-Unis d’Amérique avec des symp-
tômes d’immunodéficience similaires à ceux observés
chez les patients VIH [11, 12]. Des études rétrospectives
montrèrent que, dès la fin des années 1960, une épidémie
d’immunodépression avec apparition d’infections opportu-
nistes avait eu lieu chez d’autres singes rhésus dans un
centre californien, et que le virus de ces animaux avait
été introduit au NERPRC [13]. Une même infection fut
également décrite chez les macaques à face rouge
(Macaca arctoides) [14]. Dans les deux cas, les macaques
infectés avaient été en contact avec des mangabeys
enfumés (Cercocebus atys) non malades, diagnostiqués
rétrospectivement comme porteurs du SIVsmm. Les
relations phylogénétiques proches entre l’ensemble de
ces SIV suggérèrent que le virus de mangabey enfumé
(SIVsmm) était la source de contamination chez les maca-
ques [15]. Ce changement d’hôte avait induit une maladie
semblable au sida chez le macaque. Dès lors, l’origine
simienne du sida chez l’Homme fut suspectée.
D’après la littérature actuelle, une sérologie SIV positive a
pu être mise en évidence chez au moins 40 espèces de
primates non humains (PNH), dont les trois quarts ont été
confirmés par des séquences virales (génomes complets
pour 27 lignées de SIV et partiels pour 11) (tableau 1).
De manière remarquable, seuls les PNH africains sont
naturellement infectés par des SIV. Le nombre d’espèces
infectées pourrait être sous-estimé sachant que des virus
SIV ont été retrouvés dans 90 % des espèces de singes
examinées à ce jour et qu’il y a au total 73 espèces de
PNH en Afrique subsaharienne. La majorité des infections
SIV a été identifiée par des tests de dépistage ou confirma-
tion du VIH, grâce aux réactions croisées avec les antigènes
SIV chez les primates non humains Transmissions SIV singe-Homme
Co-evolutions virus-hôte
Transmissions inter-espèces
Recombinaisons entre des lignées SIV divergentes
Début de la divergence des VIH dans la population humaine
Découverte du VIH-1 M
Découverte du VIH-1 O
Découverte du VIH-1 N
Découverte du VIH-1 P
Découverte du VIH-2 en Afrique de l'Ouest
Suspicion d'une origine simienne du VIH
Identication de
- SIVmac chez des macaques en captivité
- SIV chez des singes sauvages
Identication d'une épidémie hétérosexuelle en Afrique
≈ 1908
≈ 1920
≈ 1932-35
≈ 1963
MRCA VIH-1 M
MRCA VIH-1 O
MRCA VIH-2 A et B
MRCA VIH-1 N
1900
1959
1979-
1981
1983
1984
1986
1990
1998
2005-
2006
2009
Plus ancien sérum VIH-1 M positif
Premiers cas de SIDA identiés chez des hommes homosexuels
des Etats-Unis d'Amérique
Identication des réservoirs des ancêtres du VIH-1 M, et des VIH-2
A et B, en Afrique Centrale et Afrique de l'Ouest, respectivement
33M de personnes infectées par le VIH-1 M
? Nouvelles émergences lentivirales : VIH-3, VIH-1 Q, VIH-2 l, ... ?
Figure 1. Émergence et pandémie de VIH : histoire, découvertes,
et perspectives.
Frise indiquant les étapes majeures dans l’émergence et l’évolution
du VIH, l’épidémie et les découvertes scientifiques. Écrits en violet,
les faits majeurs de l’épidémie de VIH chez l’Homme ; en noir dans
les cadres mauves, les découvertes successives des différents
types et groupes de VIH. Le nombre de personnes vivant avec le
VIH dans le monde augmente au cours du temps, comme schéma-
tisé par le triangle violet. Les flèches grises verticales représentent
le temps.
revue
172 Virologie, Vol. 14, n
o
3, mai-juin 2010
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

Tableau 1. Infections SIV chez les primates non-humains d’Afrique.
Genre Espèce sous-espèce Nom commun SIV
Pan troglodytes troglodytes chimpanzé d’Afrique Centrale SIVcpzPtt
troglodytes schweinfurthii chimpanzé d’Afriquedel’Est SIVcpzPts
Gorilla gorilla gorilla gorilledel’ouest SIVgor 1
Colobus guereza colobe guéréza SIVcol
Piliocolobus badius badius colobe bai d’Afrique occidentale SIVwrcPbb 2
badius temminckii colobe bai de Temminck SIVwrcPbt 2
tholloni colobe bai de Thollon SIVtrc* 3
rufomitratus tephrosceles colobe rouge d’Ouganda SIVkrc* 4
Procolobus verus colobe vert SIVolc
Lophocebus albigena mangabey à joues grises/blanches
aterrimus mangabey huppé, cercocèbe noir SIVbkm* 5
Papio anubis babouin de Guinée/anubis
cynocephalus babouin cynocéphale/jaune SIVagm-Ver*
ursinus babouin chacma SIVagm-Ver*
Cercocebus atys mangabey enfumé SIVsmm
torquatus mangabey à collier blanc/couronné SIVrcm
agilis mangabey agile SIVagi*
Mandrillus sphinx mandrill SIVmnd-1,-2
leucophaeus drill SIVdrl
Allenopithecus nigroviridis singe des marais, cercopithèque noir et vert
Miopithecus talapoin talapoin du sud, miopithèque talapoin SIVtal*
ogouensis talapoin du nord, miopithèque de l’ogooué SIVtal
Erythrocebus patas singe rouge/patas SIVagm-sab*
Chlorocebus sabaeus singe sabeus SIVagm-Sab
aethiops grivet d’Éthiopie SIVagm-Gri
tantalus cercopithèque tantale SIVagm-Tan
pygerythrus vervet SIVagm-Ver
Cercopithecus diana cercopithèque diane
nictitans singe hocheur SIVgsn
mitis singe bleu SIVblu
albogularis cercopithèque à diadème SIVsyk
mona cercopitheque mona SIVmon
campbelli singe des palétuviers
pogonias cercopithèque pogonias
denti singe mona de Dent SIVden
wolfi cercopithèque de Wolf SIVwol* 3
cephus moustac SIVmus
erythrotis moustac à oreilles rousses SIVery
ascanius cercopithèque ascagne SIVasc*
lhoest cercopithèque de l’Hoest SIVlho
solatus cercopithèque à queue de soleil SIVsun
preussi cercopithèque de Preuss SIVpre* 6
hamlyni cercopithèque de Hamlyn
neglectus cercopithèque de Brazza SIVdeb
Pour chaque espèce de primate infectée sont donnés le genre, l’espèce, la sous-espèce (s’il y a lieu), ainsi que le nom commun français. Les espèces
réservoirs des VIH-1 et 2 sont présentées en gras ; en gris clair sont les espèces dont seule une sérologie positive aux SIV a pu être mise en évidence ;
en noir, les espèces dont l’infection SIV a été confirmée par amplification virale et séquençage, les SIV sont alors notés selon la nomenclature d’usage
(une astérisque indique les SIV dont seules des séquences partielles sont disponibles). Référence pour l’ensemble des données : Bibollet-Ruche et al.,J
Virol, 2004 [89] ;
1
Van Heuverswyn et al.,Nature, 2006 [31] ;
2
Liégeois et al.,J Virol, 2009 [90] ;
3
Ahuka Mundeke et al., Poster #597/92P, Conférence
Francophone VIH/sida, 2010 ;
4
Goldberg et al.,J Virol, 2009 [80] ;
5
Takemura et al.,J Gen Virol, 2005 [91] ;
6
VandeWoude and Apetrei, Clin Microbiol
Rev, 2006 [92].
revue
Virologie, Vol. 14, n
o
3, mai-juin 2010 173
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

du rétrovirus humain. Des tests « faits maison » spécifiques
de SIVont par ailleurs été mis au point afin d’augmenter la
sensibilité de détection de certains variants viraux. Cepen-
dant, on ne peut exclure que des infections SIV restent
indétectables dans l’ensemble de ces tests, en particulier
les infections par des SIV encore inconnus [16, 17].
Les virus SIV présentent une grande diversité génétique.
Cependant, chaque espèce de PNH est généralement infec-
tée par des variants spécifiques qui forment une lignée
monophylétique dans la radiation des SIV (figure 2). Pour
chaque espèce infectée, le virus est indiqué par SIV suivi de
trois lettres en minuscule référant au nom commun anglais
de l’espèce infectée (exemple : SIVcpz pour les SIV infec-
tant les chimpanzés), et les initiales du nom latin de la
sous-espèce peuvent être ajoutées si nécessaire (exemple :
SIVcpzPtt pour les SIV infectant les chimpanzés de la
sous-espèce Pan troglodytes troglodytes)(tableau 1).
Question de la pathogénicité
des SIV chez leurs hôtes naturels
Les SIV n’induisent pas d’immunodéficience chez leurs
hôtes naturels [18], ce qui suggère une évolution virus-
hôte depuis de nombreuses années. Cette absence de patho-
génicité a été particulièrement étudiée chez les mangabeys
enfumés et les singes verts, dont l’espérance de vie et l’état
immunitaire ne sont pas affectés lors d’infections aux
SIV [19-21]. Cependant, quelques cas d’immunodéfi-
cience chez des singes en captivité ont pu être mis en
évidence, mais en général à un âge qui dépasse celui en
milieu naturel [22]. De plus, le paradigme généralisant la
non-pathogénicité des SIV chez leurs hôtes naturels sauva-
ges a été remis en question par une étude récente chez les
chimpanzés sauvages d’Afrique de l’Est (Pan troglody-
tes schweinfurthii). L’infection par un virus SIVcpzPts
aurait un impact négatif sur la santé des animaux infectés
ainsi que sur leur reproduction et leur espérance de vie [23].
Ce syndrome d’immunodéficience serait semblable à celui
retrouvé chez l’Homme affecté par le sida, bien que le
SIVcpzPts apparaisse comme moins virulent. Des études
supplémentaires sont nécessaires pour confirmer ces
résultats, mais surtout pour savoir si les chimpanzés de la
sous-espèce P. t. troglodytes sont aussi atteints d’immuno-
déficience lors d’une infection par SIVcpzPtt.
L’évolution des lentivirus SIV/VIH est
particulièrement complexe
L’évolution des SIV et des différentes lignées est très
complexe et n’est toujours pas résolue. Il y a de nombreux
exemples de coévolution entre ces virus et leurs hôtes, mais
également des exemples de recombinaisons entre des SIV
relativement distants, puisqu’une même espèce de primate
peut aussi être porteuse de deux SIV différents. Bien qu’il
semble aujourd’hui clair, au vu des phylogénies des SIV et
de leurs hôtes, qu’une simple codivergence n’ait pu avoir
lieu [24, 25], certaines associations SIV-hôte suggèrent une
coévolution sur de très longues périodes, comme les SIV
chez les quatre espèces de singes verts (Chlorocebus sp)
ou chez les espèces de Cercopithèques arboricoles
(Cercopithecus sp). Cependant, les multiples transmissions
interespèces entre des singes qui sont génétiquement
proches peuvent donner une impression erronée de la
coévolution, surtout lorsque les chances de succès de trans-
mission interespèces sont plus élevées chez les espèces
génétiquement proches [24]. Il y a en effet de nombreuses
évidences de transmissions interespèces de SIV chez les
primates vivant dans les mêmes régions géographiques ou
en association polyspécifique. Par exemple, les SIVagm
des singes verts ont été transmis aux singes patas en
Afrique de l’Ouest [26] ou aux babouins jaune et chacma
en Afrique du Sud [27, 28]. Il y a aussi des exemples plus
complexes comme les transmissions interespèces des SIV
entre les singes hocheurs (SIVgsn) et moustacs (SIVmus),
suivies de recombinaisons retrouvées chez SIVmus-2 chez
les moustacs [29] (tableau 1).L’exemple le plus marquant
de transmission interespèces suivie de recombinaison est
celui des SIV infectant les chimpanzés. En effet, les SIVcpz
sont le résultat d’une recombinaison entre deux virus : les
ancêtres des SIVrcm (partie 5’) des mangabeys à collier
blanc et des SIVgsn (partie 3’) des singes hocheurs [30].
SIVcpz/SIVgor/VIH-1
SIVrcm
SIVmnd-2
SIVdrl
SIVagm-Sab
SIVgsn
SIVmus
SIVmon
SIVery
SIVasc
SIVbkm
SIVtal
SIVden
SIVdeb
SIVcol
SIVsyk
SIVlho
SIVsun
SIVwrc
SIVolc
SIVmnd-1
SIVsmm/VIH-2
SIVagm-Ver
SIVagm-Tan
SIVagm-Gri
0.1
pol
Figure 2. Diversité génétique et évolution des différentes lignées
SIV/VIH.
Analyse phylogénétique par neighbor-joining d’un alignement
de séquences partielles du gène pol (512 pb) de SIV infectant
diverses espèces de primates non-humains et de VIH infectant
l’Homme. Les longueurs de branche sont à l’échelle (la barre
d’échelle représente 0,1 substitution par site). Les nuances de
gris permettent une meilleure lecture de la figure en différenciant
les SIV d’espèces distinctes. Les lignées VIH-1/-2 sont présentées
en violet. Les différentes lignées SIV et leur hôte peuvent être
retrouvés dans le Tableau 1.
revue
174 Virologie, Vol. 14, n
o
3, mai-juin 2010
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

Cette recombinaison virale a pu avoir lieu lors d’une surin-
fection probablement chez le chimpanzé, carnivore de
petits singes, et a donné lieu à l’actuelle lignée de SIVcpz.
Les chimpanzés ont ensuite pu transmettre leur virus à
des gorilles [31, 32].
Les coévolutions virus-hôtes, les transmissions interespèces,
les surinfections, ou les recombinaisons virales sont parmi
les nombreuses caractéristiques évolutives des SIV qui
rendent leur histoire si complexe à résoudre.
Des contacts avec du sang, des sécrétions ou des tissus
infectés entre les PNH de différentes espèces peuvent
avoir lieu lors de combats, d’infanticides, d’associations
polyspécifiques, ou pendant la chasse et la consommation
de petits singes comme pour les chimpanzés. Les transmis-
sions interespèces présentées précédemment seraient donc
possibles lors de tels contacts avec un animal infecté. Si des
transmissions interespèces ont pu être observées entre les
PNH, les virus SIVont aussi pu franchir à plusieurs reprises
la barrière d’espèce lors de transmissions virales de singes à
l’Homme, comme détaillées dans les prochaines sections.
Le sida, dont l’agent étiologique est le VIH, peut donc être
considéré comme une zoonose [33]. Les SIV les plus
proches du VIH-1 sont le SIVcpz et le SIVgor qui infectent
naturellement les chimpanzés (P. t. troglodytes) et les
gorilles (Gorilla gorilla gorilla)d’Afrique équatoriale de
l’Ouest. Les SIVsmm retrouvés chez les mangabeys
enfumés (Cercocebus atys)d’Afrique de l’Ouest sont les
plus proches du VIH-2.
Les SIV chez les grands singes d’Afrique
sont à l’origine du VIH-1
Le VIH-1 infectant l’Homme est maintenant connu pour
être composé de quatre groupes : le groupe M pour
« Major », découvert en 1983 [1] et responsable de la
pandémie actuelle de sida ; le groupe O ou « Outlier »
découvert en 1990 [34] ; le groupe N, pour « Non-M
Non-O », identifié en 1998 [35] ; et depuis août 2009,
un virus d’un nouveau groupe a été caractérisé chez
deux personnes d’origine camerounaise, en France et au
Cameroun, et ce groupe a été appelé VIH-1 groupe P [36]
(Brennan et al., Oral #25, CROI 2010) (figure 1). Chaque
groupe du VIH-1 résulte d’une transmission interespèces
de SIV de grands singes à l’Homme.
Les questions sur l’origine du VIH-1 sont de plusieurs
ordres : quels sont les réservoirs à l’origine du VIH-1
retrouvé chez l’Homme ? Combien d’événements de trans-
mission sont impliqués ? Où ces transmissions interespèces
se sont-elles déroulées ? Quand et comment ont-elles
eu lieu ?
Les SIV des chimpanzés et des gorilles sont
àl’origine du VIH-1 chez l’Homme
L’hypothèse selon laquelle les chimpanzés puissent être
les réservoirs du VIH-1 fut établie en 1989 lorsque des
infections lentivirales par des SIV isogéniques et proches
phylogénétiquement du VIH-1 furent caractérisées chez
deux chimpanzés nés dans la nature et captifs au Gabon
(Gab1 et Gab2) [37, 38]. La caractérisation d’un troisième
SIVcpz (SIVcpzANT) infectant un chimpanzé de RDC et
saisi en Belgique par les douanes révéla une très grande
et inattendue diversité génétique entre l’ensemble des sou-
ches SIVcpz caractérisées [39]. Néanmoins, cette grande
diversité a pu être expliquée lorsque la phylogénie des
SIVcpz fut analysée en prenant en compte les différentes
sous-espèces de chimpanzés [40]. Ainsi, il a pu être mis en
évidence que les chimpanzés P. t. troglodytes dans la partie
ouest d’Afrique équatoriale et les P. t. schweinfurthii en
Afrique équatoriale de l’Est étaient chacun infectés
par des SIVcpz spécifiques des sous-espèces, et que
les SIVcpzPtt étaient les plus proches virus du VIH-1
(figure 3). Si ces données suggéraient fortement que les
chimpanzés d’Afrique équatoriale de l’Ouest étaient la
source du VIH-1, la mise en évidence du réservoir de
façon définitive imposait de pouvoir étudier un nombre
plus important de chimpanzés vivant dans la nature. C’est
la mise au point, en 2002, de méthodes non invasives pour
ces espèces protégées qui a permis la caractérisation
des SIV infectant les grands singes sauvages à partir
d’échantillons fécaux [41, 42]. Par cette méthode, de
nouvelles souches de SIVcpz provenant de chimpanzés
sauvages vivant en Tanzanie et en RDC, et appartenant
à la sous-espèce P. t. schweinfurthii ont été caractérisées
[43] (Li et al., Poster #440, CROI 2010). Toutes ces
nouvelles souches SIVcpzPts forment une lignée proche
du SIVcpzANT et distincte de celle du VIH-1, confirmant
que ces variants ne sont pas à l’origine des virus infectant
l’Homme [44]. En revanche, les études d’épidémiologie
moléculaire des SIVcpz infectant les chimpanzés du
Cameroun ont permis d’identifier en 2006 les réservoirs
des virus humains pandémiques (VIH-1 M) et non pandé-
miques (VIH-1 N) [45]. En effet, cette étude montre que les
souches virales ancêtres du VIH-1 M appartiennent à une
lignée de SIVcpzPtt qui persiste aujourd’hui chez des
groupes de chimpanzés sauvages, de la sous-espèce
troglodytes, vivant dans l’extrême sud-est du Cameroun
(figure 3). De plus, il est apparu que le VIH-1 groupe N
a pour origine une autre lignée de SIVcpzPtt infectant
des animaux du centre du Cameroun (figure 3). Au total,
la distribution des SIVcpzPtt chez les chimpanzés
d’Afrique équatoriale de l’Ouest est étendue mais
inégale [46]. Aussi, dans l’arbre évolutif, ces virus se
regroupent selon leur site d’origine de collecte, phénomène
appelé regroupement phylogéographique. Depuis 2003,
revue
Virologie, Vol. 14, n
o
3, mai-juin 2010 175
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%