baccalauréat général - cours

BBSPETS2014 Page : 1/10
BACCALAURÉAT GÉNÉRAL BLANC
______
PHYSIQUE–CHIMIE
Série S
____
DURÉE DE L’ÉPREUVE : 3 h 30 – COEFFICIENT : 8
______
L’usage d'une calculatrice EST autorisé
Ce sujet ne nécessite pas de feuille de papier millimétré
Ce sujet comporte trois exercices présentés sur 10 pages numérotées de 1 à 10.
La page 9 de l'ANNEXE EST À RENDRE AVEC LA COPIE,
même si elle n’a pas été complétée.
Le candidat doit traiter les trois exercices qui sont indépendants les uns des autres.
Exercice I : Les dangers de l'alcool (8,5 points)
Exercice II : Une méthode pour détecter une exoplanète (6,5 points)
Exercice III : Utilisation d’une installation couplant voiture à Hydrogène et panneaux photovoltaïques
(5 points)

BBSPETS2014 Page : 2/10
EXERCICE I – Les dangers de l’alcool (8,5 points)
A. Spectroscopie
On se propose d'étudier la structure et les fonctions organiques de ces molécules par spectroscopie.
A.1. Le texte évoque les molécules d'éthanol et d'éthanal : représenter en formule semi–développée ces deux
molécules et encadrer leurs fonctions caractéristiques.
A.2. Quel est le nom du groupe fonctionnel porté par l'éthanol ? À quelle famille appartient cette molécule ?
A.3. Quel est le nom du groupe fonctionnel porté par l'éthanal ? À quelle famille appartient cette molécule ?
A.4. En utilisant les données spectroscopiques des documents 1, 2 et 3 de l'ANNEXE 1, associer chaque
spectre infrarouge (IR) à la molécule correspondante en justifiant.
A.5. Le document 4 de l'ANNEXE 1 présente le spectre RMN de l'éthanol. En utilisant la courbe d'intégration,
calculer les rapports h1
h2 et h3
h2.
A.6. Utiliser les rapports calculés pour associer aux trois massifs du spectre, les groupes de protons
équivalents de l'éthanol.
A.7. Le massif de pics situé au déplacement chimique 1,25 ppm se présente sous la forme d'un triplet. En
utilisant la règle des (n+1)–uplets, justifier cette multiplicité en évoquant le nombre d'atomes d'hydrogène
voisins.
On trouve dans un document publié par l'Institut suisse de prévention de l'alcoolisme (ISPA) les
informations suivantes :
Quand une personne consomme de l'alcool, celui–ci commence immédiatement à passer dans le
sang. Plus le passage de l'alcool dans le sang est rapide, plus le taux d'alcool dans le sang
augmentera rapidement, et plus vite on sera ivre. L'alcool est éliminé en majeure partie par le foie.
Dans le foie, l'alcool est éliminé en deux étapes grâce à des enzymes.
Dans un premier temps, l'alcool est transformé en éthanal par l'enzyme alcool
déshydrogénase (ADH). L'éthanal est une substance très toxique, qui provoque des dégâts
dans l'ensemble de l'organisme. Il attaque les membranes cellulaires et cause des
dommages indirects en inhibant le système des enzymes.
Dans un deuxième temps, l'éthanal est métabolisé par l'enzyme acétaldéhyde
déshydrogénase (ALDH).
www.sfa–ispa.ch
Alcool pur : Ethanol : C2H6O
Enzyme ADH
Ethanal C2H4O
Dégradation ultérieure...
Synthèse du cholestérol

BBSPETS2014 Page : 3/10
B. L’acidité d’un vin
Données : Masse molaire de l’acide éthanoïque (CH3COOH) : M = 60 g.moL–1
À 25°C : pKA (acide éthanoïque/ion éthanoate) = 4,8
pKA (acide lactique/ion lactate) = 3,9
pKA (ion oxonium/eau) = 0
pKA (eau/ion hydroxyde) =14
produit ionique de l’eau : Ke = 1,0×10 14
1. À propos du texte
B.1.1. Déterminer la valeur de la concentration molaire en ions oxonium H3O+ d’un vin dont le pH est égal à 3,0.
B.1.2. Calculer la concentration molaire de l’acide éthanoïque pour que le goût aigre soit perçu.
2. Réaction de l’acide éthanoïque avec l’eau
On dispose d’un volume V = 50 mL d’une solution S d’acide éthanoïque de concentration molaire en soluté
apporté C = 1,0×10–2 mol.L–1 et de pH = 3,4.
B.2.1. Écrire l’équation de la réaction de l’acide éthanoïque avec l’eau.
B.2.2. Tracer le diagramme de prédominance du couple acide éthanoïque / ion éthanoate et en déduire
l’espèce prédominante dans la solution S.
B.2.3. Calculer la concentration molaire en ions oxonium H3O+ de la solution S puis l’avancement final de la
réaction (on peut s’aider d’un tableau d’avancement).
B.2.4. Montrer que la transformation n’est pas totale.
L’acidité d’un vin peut être exprimée de deux façons, à partir de son acidité totale ou de son pH [...]. L’acidité
totale est surtout un indicateur des caractéristiques gustatives, alors que le pH intervient dans la stabilité du
vin. L’acidité du vin (pH compris entre 2,7 et 3,7) est principalement due à la présence d’acides organiques
en partie à l’état libre; l’acidité totale d’un vin est constituée par les acides représentant l’acidité fixe (acides
tartrique, malique, lactique, citrique, etc) et par des molécules représentant l’acidité volatile (essentiellement
l’acide éthanoïque, et l’éthanoate d’éthyle susceptible de libérer l’acide éthanoïque par saponification) [...].
Le goût aigre de l’acide éthanoïque est perçu lorsque sa concentration est supérieure à 0,6 g.L–1.
D’après « Chimie dans la maison » – Cultures et Techniques

BBSPETS2014 Page : 4/10
C. Contrôle de qualité d'un vin : dosage par spectrophotométrie de l'éthanol.
On peut lire dans le code de la santé publique depuis juin 2000 : catégorie Vins doux : vins, apéritifs à base de
vin ne titrant pas plus de 18 degrés.
Définition : Le titre alcoométrique, exprimé en degré, est égal au nombre de litres d'éthanol contenus
dans 100 litres de vin.
On se propose de vérifier en laboratoire si un vin obéit à cette législation.
Afin de procéder au contrôle, on réalise le titrage par spectrophotométrie du vin en suivant le protocole suivant :
1ère étape : On recueille l'éthanol du vin par distillation.
2ème étape : L'éthanol est oxydé par la NAD+ dans une réaction catalysée par une enzyme spécifique. La
réaction produit de la nicotinamide–adénine–dinucléotide réduite (NADH) en quantité de matière
égale à celle de l'éthanol dosé selon l'équation :
Ethanol + NAD+ Ethanal + NADH + H+
3ème étape : La NADH absorbant dans le domaine UV, on mesure son absorbance par spectrophotométrie.
L'étalonnage du spectrophotomètre avec différentes solutions d'éthanol a permis de tracer la courbe A = f(Cm),
où Cm désigne la concentration massique d'éthanol dans l'échantillon et A est l’absorbance mesurée (voir
ANNEXE 2)
Réalisation de la mesure :
On distille 10 mL de vin ; le distillat est ensuite ajusté à 100 mL avec de l'eau distillée pour obtenir une
solution appelée S.
On prépare l'échantillon à doser par spectrophotométrie en introduisant, dans une fiole jaugée de 100 mL,
1 mL de solution S, le catalyseur, NAD + en excès,
On complète avec de l'eau distillée.
L'absorbance mesurée pour cet échantillon vaut : Ae = 0,24.
Données : M(éthanol) = 46,0 g.mol –1 µ(éthanol) = 0,78 g.mL–1
C.1. Quel est le rôle et l’intérêt d’utiliser l’enzyme spécifiée dans la 2ème étape du protocole ?
C.2. Montrer que l'étalonnage du spectrophotomètre avec les différentes solutions d'éthanol permet de vérifier
la loi de Beer–Lambert : A = k.Cm avec k = 1,6x10–3 L.mg–1
C.3. Déterminer à partir de l'absorbance mesurée Ae, la concentration massique Cm en éthanol de l'échantillon
étudié
C.4. En tenant compte des deux dilutions successives, calculer les concentrations massiques en éthanol
suivantes:
C.4.1 CS dans la solution S.
C.4.2. CV dans le vin.
C.5. Quelle est la valeur du titre alcoométrique exprimé en degrés du vin ?
C.6. Ce vin est–il conforme au code de la santé publique ?

BBSPETS2014 Page : 5/10
Etoile
Exoplanète
Centre de gravité
EXERCICE II – Une méthode pour détecter une exoplanète (6,5 points)
Il est exceptionnel de détecter visuellement des exoplanètes à
cause de la forte luminosité des étoiles comparée à celle des
planètes. De plus, à cause de leur éloignement, la plupart des
étoiles sont réduites à un point lumineux, même avec un télescope
puissant.
Malgré tout, un millier d'exoplanètes a pu être détecté par diverses
méthodes comme la méthode des "vitesses radiales" en utilisant le
spectre de l’étoile.
En effet, la présence d'une exoplanète dans le voisinage d'une étoile
perturbe cette dernière. L'étoile a alors un mouvement de révolution
autour du centre de gravité de l'ensemble {exoplanète–étoile}.
Le déplacement des raies sombres dans le spectre de l'étoile est la signature du mouvement de la planète et
de l'étoile autour de leur centre de gravité. La détermination de la vitesse radiale par le décalage Doppler
permet de tracer la courbe de vitesse radiale et ainsi de déterminer la présence d'une grosse planète ainsi que
sa période de révolution T.
Dans cet exercice, on s’intéressera à l’exoplanète Pegase 51b (première planète découverte autour d’une
étoile par la méthode des vitesses radiales en 1995 par Michel Mayor et Didier Queloz de l'Observatoire de
Genève) située autour de l'étoile Pégase 51 a.l de la Terre.
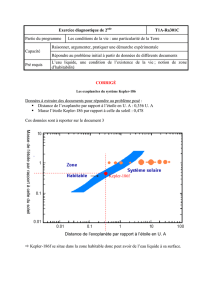
Les graphiques donnés en ANNEXE 3 représentent le spectre de l’étoile observé depuis la Terre, à quelques
jours d’intervalle.
On s’intéresse aux 2 raies d’absorption les plus marquées : elles correspondent à deux raies du spectre du
sodium qui constituent le doublet du sodium Na1 = 588,9950 nm et Na2 = 589,5924 nm.
Données : Célérité de la lumière dans le vide c = 299 792 km.s–1
Constante de Planck h = 6,63.10–34 J.s
1. Nature des transitions
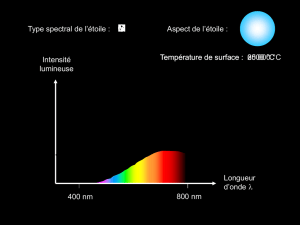
1.1. Quel type de spectre obtient–on lorsqu’on analyse la lumière émise par cette étoile ?
1.2. Calculer l’énergie du photon associée à la 1ère raie du sodium Na1. S’agit–il d’une transition électronique
ou vibrationnelle ?
1.3. Calculer la fréquence fNa1 de la 1ère raie du sodium.
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%