Exercices corrigés de révision pour le passage en - trole

NOM : Prénom :
Série S – Révisions de première – Entraînement
Etre prêt(e) pour la Terminale S
Le programme de terminale S étant très dense en physique chimie, avec en moyenne un chapitre par
semaine, autant y être préparé afin de bien démarrer l’année.
Voici donc quelques exercices portant sur des notions de Première S et dont vous aurez besoin en
Terminale.
Pour ce qui est du support de cours, vous disposez de vos polycopiés ainsi que du site
http://christrole.free.fr . Les corrections sont à la fin !
A chacun son rythme, et bon courage.
CT
Merci beaucoup à Mme Charbonnier qui a composé ce recueil d’exercices !
Sommaire :
1
A- Des outils incontournables… ........................................................................................................ 2
B- Interactions fondamentales .............................................................................................................. 3
C- Notion de champ ........................................................................................................................ 4
D- La couleur ................................................................................................................................... 5
E- Le photon ....................................................................................................................................... 6
F- Energies ........................................................................................................................................... 7
G- Transfert thermique ..................................................................................................................... 8
H- Molécules .................................................................................................................................... 9
I- Solide ioinique ............................................................................................................................... 10
J- Dissolution et dilution .................................................................................................................... 10
K- Avancement ................................................................................................................................... 12
L- Solutions colorées ........................................................................................................................... 13
M- Molécules organiques ................................................................................................................. 15
N- Oxydoréduction ......................................................................................................................... 16
Réponses .................................................................................................................................................. 17

P a g e | 2
Série S – Révisions de première – Entraînement
A- Des outils incontournables…
La notation scientifique
Vous connaissez les coloriages magiques… Retour en enfance ! Je vous en propose trois… en travaillant
correctement, vous découvrirez ce qui se cache dans ces dessins !!!
A×101 Blanc A×100 Noir A×102 Marron
A×103 Bleu A×10-1 orange A×10-2 jaune A×10-3 Gris
Ordre de grandeur
101 jaune 102 Gris 103 Violet
10-1 Marron 10-2 Noir 10-3 Bleu

P a g e | 3
Série S – Révisions de première – Entraînement
Chiffres significatifs
1 Chiffre significatif Gris 2 Chiffres significatifs Bleu 3 Chiffres significatifs Vert
4 Chiffres significatifs Orange 5 Chiffres significatifs Jaune
B- Interactions fondamentales
Exercice 1
Calculer la valeur numérique des deux forces de Newton s'exerçant entre la Terre (M = 5,98 × 10 24 kg) et la
Lune (m = 7,34 × 10 22 kg). On suppose que la distance entre la Terre et son satellite reste égale à 384000 km.
Représenter ces deux forces sur un schéma
Constante de gravitation
G = 6,67 × 10 - 11 N.m ² / kg ².
Exercice 2
Déterminer les valeurs des interactions gravitationnelles et électriques qui existent entre le noyau d’un atome
d'hydrogène et son électron.
Indiquer laquelle de ces interactions assure la cohésion de la matière à l’échelle atomique.
Données:
masse du proton : mp = 1,673x10-27 kg. masse du neutron : mn = 1,675x10-27 kg.
masse de l’électron : me = 9,109x10-31 kg. charge élémentaire : e=1,60x10-19 C.
constante de gravitation universelle : G=6,67x10-11 N.m2.kg-2.
k=9,0x109 N.m2.C-2.
distance moyenne noyau électron de l’atome d’hydrogène: d=53,0 pm.

P a g e | 4
Série S – Révisions de première – Entraînement
C- Notion de champ
Exercice 1 : QCM
Pour chacune des questions ci-dessous, Indiquer la bonne ou les bonnes réponses.
1. Les lignes d’égales valeurs sont :
a. Obtenues en reliant des points où la grandeur étudiée a même valeur.
b. Des courbes orientées.
c. Plus proches lorsque la variation de la valeur mesurée est plus importante.
2. Les champs vectoriels :
a. Sont caractérisés par des lignes de champ parallèles entre elles.
b. Peuvent être uniformes.
c. Sont caractérisés par des lignes d’égales valeurs.
3. Un champ est dit scalaire :
a. Lorsque la grandeur physique mesurée est caractérisée par un vecteur.
b. Lorsque la grandeur qui le définit reste constante en tout point de l’espace.
c. Lorsque la grandeur étudiée est caractérisée par sa valeur.
Exercice 2
1. Quelle est l'origine du champ de pesanteur présent sur Terre ?
2. Représenter le champ de pesanteur créé par la Terre en quelques points de sa surface. Comment les vecteurs
sont-ils orientés ?
3. Quelle est la caractéristique du champ de pesanteur dans une zone restreinte de la surface terrestre ?
4. À votre avis, cette différence entre le champ de pesanteur à l'échelle de la Terre et à l'échelle locale se retrouve-t-
elle sur la Lune ? Justifier votre réponse.
5. Calculer la valeur de la pesanteur terrestre au niveau du sol.
Données :
Constante de gravitation universelle : G=6,67x10-11 N.m2.kg-2.
Rayon moyen de la Terre : RT=6371 km.
Masse de la Terre : MT=5,97x1024 kg.
Exercice 3
1. Rappeler la définition d'un condensateur plan.
2. Décrire l'origine du champ électrostatique entre les armatures d'un condensateur plan soumis à une tension
électrique. Quels sont la direction et le sens des vecteurs du champ ?
3. Quelle est la valeur du champ électrostatique à l'intérieur d'un condensateur dans lequel une particule de charge
1,0 mC subit une force de 1,0×10−2 N ?
4. Calculer la valeur du champ électrostatique à l'intérieur d'un condensateur d'épaisseur 0,50 mm chargé sous une
tension de 10 V.
5. En déduire la force que subirait une charge de 5,0 nC qui serait placée entre les armatures de ce condensateur.

P a g e | 5
Série S – Révisions de première – Entraînement
D- La couleur
Exercice 1
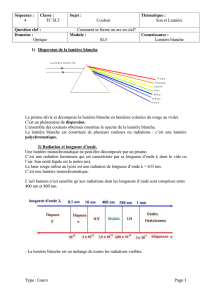
Un tunnel routier est éclairé par des lampes à vapeur de sodium, qui dispensent une lumière
monochromatique jaune.
Dans ce tunnel, quelle est la couleur perçue d’une voiture qui, en plein jour parait : blanche ? bleue ? jaune ?
noire ?
Exercice 2
Le dessin ci-contre est tiré sur une imprimante à jet d'encre qui n'utilise que trois types
de cartouches: cyan, magenta et jaune.
Pour chacun des éléments de la photo (anorak, pantalon, gants, chaussures de ski, skis,
ciel, neige,) déterminer quelles sont les encres utilisées.
Exercice 3
1. Quelle est la fréquence ν1, d'une radiation de longueur d'onde dans le vide λ1=632,8 nm ?
2. Quelle est la longueur d'onde dans le vide λ2 d'une radiation de fréquence ν2=5,64×1014 Hz ?
Donnée
: célérité de la lumière dans le vide : c=3,00×108 m.s−1.
Exercice 4
La température de surface de l'étoile Spica, dans la constellation de la Vierge, est d'environ 20000°C.
1. Enoncer la loi de Wien en précisant le nom et l’unité des grandeurs physiques dans cette loi.
2. Indiquer comment évolue le rayonnement thermique d’une étoile lorsque sa température de surface augmente.
3. Calculer la longueur d'onde dans le vide de la radiation émise avec le maximum d'intensité par l'étoile Spica. À
quel domaine appartient-elle ?
4. Exprimer la longueur d’onde qui correspond à l’intensité maximale du rayonnement thermique de l’étoile en
fonction de sa température de surface.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
1
/
33
100%