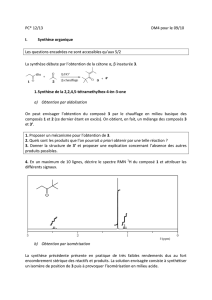
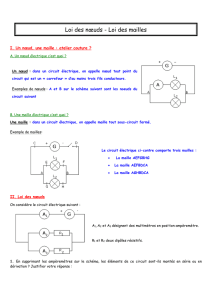
Eléments de cristallographie pour autonomie.jnt

Eléments de cristallographie
Ce document est destiné au travail en autonomie à réaliser au cours du module
IDMtc 1 « De la Matière aux Matériaux : Structure et Propriétés », de l’UE "Ingénierie
des Matériaux". Il correspond à une quantité de travail de 2 heures environ.
Ce document doit être lu et assimilé et les exercices dont les énoncés sont fournis en
dernière page doivent être résolus avant la cinquième séance de 2 heures du
module (i.e. la quatrième séance de TD du module).
I. Introduction : matériaux cristallins et matériaux amorphes
Une façon de classifier la matière solide consiste à analyser la façon dont les atomes
qui la constituent s’arrangent dans l’espace. Il existe alors 2 possibilités :
• le solide cristallisé, caractérisé par un empilement périodique et régulier
d’atomes, dans l’espace tridimensionnel ;
• le solide amorphe, pour lequel l’ordre à grande distance est absent
(dans ce sens, le solide amorphe peut être assimilé à un liquide).
Chaque matériau solide peut alors être classé dans une des trois catégories
suivantes :
• matériau cristallin ;
• matériau amorphe ;
• matériau semi-cristallin (dans un même matériau, il y a coexistence de
zones amorphes et de zones cristallines les unes à côté des autres).
Exemples de matériaux
cristallins Exemples de matériaux
amorphes Exemples de matériaux
semi-cristallins
les métaux,
certains polymères,
certaines céramiques
les verres minéraux,
certains polymères,
certaines céramiques,
les verres métalliques
certains polymères,
certaines céramiques
Les matériaux cristallins peuvent exister sous deux formes : le monocristal et le
polycristal.
Une pièce monocristalline (ce qui est très rare) est constituée d’un seul cristal, alors
qu’un polycristal est constitué de nombreux cristaux (que l’on appelle des grains) liés
les uns aux autres. La taille des grains est très variable (de quelques dizaines de
nanomètres à quelques centaines de microns, voire millimètres).
A l’intérieur d’un grain d’un polycristal ou dans un monocristal, les atomes sont
régulièrement et périodiquement empilés dans l’espace. Il peut cependant y avoir
des défauts dans cet empilement (ces défauts seront étudiés lors de la prochaine
séance).
La suite de ce document présente des notions élémentaires de cristallographie
(science qui étudie les empilements cristallins), les différents empilements possibles,
ainsi que leurs caractéristiques.

II. Cristal = réseau spatial + motif
Un solide cristallin (ou cristal) est donc un ensemble d’atomes (reliés les uns au
autres par des liaisons) arrangés périodiquement suivant les 3 directions de l’espace.
Un cristal peut être décomposé en :
- un réseau spatial tridimensionnel (Figure 1) : c’est un ensemble de points
(appelés nœuds), de dimension infinie obtenu par translation dans l’espace de
3 vecteurs non coplanaires
, ,
qui déterminent les directions et les
distances entre les nœuds. Ces 3 vecteurs sont caractérisés par leurs normes
respectives a, b et c et les angles entre les vecteurs pris 2 à 2 (γ pour l’angle
entre
et
, α pour l’angle entre
et
et β pour l’angle entre
et
) et
- un motif (atome ou groupe d’atomes) : c’est l’élément de base placé en
chaque nœud et dont la répétition suivant le réseau spatial engendre le cristal.
Figure 1 : définitions du réseau spatial tridimensionnel d’un cristal
Exemple (voir Figure 2)
Pour le métal « cuivre » : le réseau spatial est cubique à faces centrées (les nœuds
de ce réseau CFC sont situés à chacun des 8 sommets d’un cube et au centre de
chacune des 6 faces) et le motif est constitué d’un atome de cuivre.
En gardant le même réseau cubique à faces centrées, l’utilisation d’un motif à 2
atomes (en fait, 2 ions liés entre eux) de Na et de Cl permet de créer le cristal de sel
NaCl.
Si le motif est constitué de 2 ions Si4+ et de 4 ions O2-, on obtient le cristal de
cristobalite β (c’est une forme de quartz).
(a)
(b)
(c)
Figure 2 : exemples du réseau CFC avec trois motifs ((a) : Cu ; (b) : NaCl ; (c) : cristobalite β
ββ
β)

Une maille est un hexaèdre : c’est un volume dont chacun des 8 sommets est un
nœud du réseau (Figure 1). Pour les réseaux bidimensionnels (réseaux plans), une
maille est un quadrilatère dont chacun des 4 sommets est un nœud du réseau.
Les paramètres d’une maille sont les distances a, b, c entre les nœuds de la maille et
les angles α, β et γ.
Une maille est dite élémentaire si les normes a, b, c des vecteurs qui définissent la
maille sont les plus petites possibles, dans les directions choisies.
Une maille élémentaire est dite primitive si elle ne contient qu’un motif.
Pour une meilleure compréhension, les explications suivantes sont données pour un
réseau bidimensionnel (plan). Toutes ces notions sont également valables pour un
réseau tridimensionnel.
Figure 3 : exemples de mailles pour un réseau bidimensionnel
Sur la Figure 3, ABCD, AEFG, HIJK et LMNO sont des mailles.
La maille ABCD n’est pas élémentaire (et donc elle n’est pas primitive).
AEFG, HIJK et LMNO sont des mailles élémentaires.
AEFG et HIJK sont des mailles élémentaires primitives.
En effet, chacune de ces 2 mailles « contient » 4 nœuds (A, E, F, G pour l’une et H, I,
J, K pour l’autre). Chacun de ces 4 nœuds appartient à 4 mailles, donc appartient, en
propre, pour ¼ à la maille considérée. Au final, 4 x ¼ = 1 nœud est contenu dans
chacune de ces 2 mailles : elles sont donc élémentaires primitives.
LMNO n’est pas primitive : en effet, pour la maille LMNO, chaque nœud L, M, N et O
appartient pour ¼ à cette maille, ce qui fait donc 4 x ¼ = 1 nœud, auquel il faut
ajouter le nœud situé au centre de la maille (qui n’appartient qu’à cette maille
considérée). Au final, la maille LMNO contient 4 x ¼ + 1 = 2 nœuds et n’est donc pas
primitive.
On peut déduire de cet exemple le fait que :
pour un réseau spatial donné, il n’y a pas unicité de la maille élémentaire primitive.

III. Les 14 réseaux de Bravais
Il existe 7 systèmes cristallins différents en fonction des relations qui peuvent exister
entre les distances entre les nœuds a, b et c et des valeurs que peuvent prendre les
angles α, β et γ (et donc en fonction de la symétrie de la forme géométrique de la
maille élémentaire primitive). Les 7 systèmes sont : Cubique, Quadratique,
Hexagonal, Rhomboédrique, Orthorhombique, Monoclinique et Triclinique.
En plaçant, pour certains de ces systèmes cristallins, des nœuds au centre de la
maille primitive, ou au centre des bases de la maille primitive, ou au centre de
chacune des 6 faces, on peut définir au total 14 réseaux cristallins : ce sont les 14
réseaux de Bravais.
1) Système cubique
Dans le système cubique, la maille est un cube.
Les relations sont donc les suivantes : a = b = c et α = β = γ = 90°.
Il existe 3 réseaux de Bravais cubiques (Figure 4) :
• Le réseau cubique simple (un nœud sur chacun des 8 sommets du cube) ;
• Le réseau cubique centré (un nœud sur chacun des 8 sommets du cube et un
nœud au centre du cube), noté CC ;
• Le réseau cubique à faces centrées (un nœud sur chacun des 8 sommets du
cube et un nœud sur chacun des centres des 6 faces), noté CFC.
(a)
(b)
(c)
Figure 4 : les 3 réseaux de Bravais cubiques ((a) : cubique simple ; (b) : CC; (c) : CFC)
Le Mn cristallise en cubique simple.
Exemples de métaux cristallisant dans le réseau cubique centré : W, Na, Cr, Fe
α
(ou fer alpha ou ferrite, pour T < 910°C), Ti (sous forme
β
), Zr, U.
Exemples de métaux cristallisant dans le réseau cubique à faces centrées : Al, Cu,
Ni, Pb, Au, Ag, Pt, Fe
γ
(ou fer gamma ou austénite, pour T > 910°C), Co, Pu.
Les exemples cités en italique sont des métaux qui peuvent cristalliser suivant
différents réseaux cristallins, en fonction de la température.
Par exemple, le fer cristallise en cubique centré si la température est inférieure à
910°C et en cubique à faces centrées si la température est supérieure à 910°C.
Le passage d’un réseau à un autre, lors de l’augmentation ou de la diminution de la
température, est appelé une transformation allotropique. Ainsi, le Fe présente deux
formes allotropiques (CC ou fer alpha à basse température et CFC ou fer gamma à
haute température) et la transformation allotropique se produit à 910°C.

2) Système quadratique
Les relations entre les paramètres de la maille sont : a = b ≠ c et α = β = γ = 90°.
Il existe 2 réseaux de Bravais quadratiques (Figure 5) :
• Le réseau quadratique simple (un nœud sur chacun des 8 sommets) ;
• Le réseau quadratique centré (un nœud sur chacun des 8 sommets et un
nœud au centre de la maille).
(a)
(b)
Figure 5 : les 2 réseaux de Bravais quadratiques
((a) : quadratique simple ; (b) : quadratique centré)
Exemples de quadratique simple : Sn, U, Pu.
Exemple de quadratique centré : Fe
α
’ (ou martensite, obtenu par refroidissement
très rapide – trempe – à partir de Fe
γ
).
3) Système hexagonal
Les relations sont : a = b ≠ c et α = β = 90° et γ = 120° (Figure 6).
Figure 6 : le système hexagonal (la maille est représentée en noir)
Il n’existe qu’un réseau de Bravais hexagonal (un nœud sur chacun des 8 sommets).
Ce système est appelé hexagonal car une façon de le représenter consiste à
« empiler », dans la direction
, des plans atomiques hexagonaux (Figure 6).
A partir du réseau hexagonal, on peut obtenir un empilement appelé hexagonal
compact ou hexagonal centré (qui n’est pas, à strictement parler, un réseau de
Bravais). Pour cela, il faut venir ajouter, à une hauteur c/2, un plan hexagonal
intermédiaire, décalé de a/2 et de b/2 (voir plus loin paragraphe V. 3). Cela revient
également à ajouter un nœud au centre de la maille. Le réseau hexagonal centré ou
compact est noté HC.
Exemple d’hexagonal simple : Hg.
Exemples d’hexagonal compact : Zn, Mg, Ti (sous forme
α)
, Co, Zr.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%