La spectroscopie - Le Repaire des Sciences

S. Bourdreux – Initiation à l’astronomie
La spectroscopie
Partie 1 : Un peu d’histoire
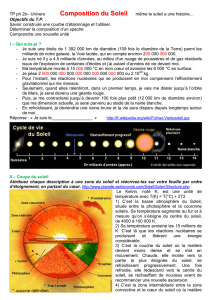
En 1801, le physicien Thomas Young démontre clairement que la lumière se propage comme une onde,
c'est-à-dire un peu comme une succession de vagues et de creux à la surface de l'eau. L'idée n'est pourtant
pas nouvelle puisque le physicien hollandais Christiaan Huygens l'avait proposée à l'époque de Newton
(1678). Cependant, Young observe les motifs créés par le passage d'un faisceau lumineux à travers des
fentes et, grâce à cette expérience, il parvient à convaincre la communauté scientifique de son époque de
la nature ondulatoire de la lumière.
Fait étonnant, Young arrive même à estimer la longueur d'onde des lumières rouge et violette, c'est-à-dire
la distance entre deux crêtes ou deux creux de vagues successifs. Pour la lumière rouge, il obtient 7
millièmes de millimètres et pour la violette, 4 millièmes de millimètres. De ces mesures et à la lueur des
travaux de Newton, il apparaît donc que la lumière de grande longueur d'onde est moins déviée que celle
de courte longueur d'onde.
À la même époque, vers 1802, le chimiste britannique William Hyde Wollaston remarque un fait
surprenant : le spectre de la lumière solaire n'est pas continu. En effet, de nombreuses raies noires
entrecoupent les couleurs du spectre. Malheureusement, il n'y porte pas une grande attention et aucune
tentative n'est avancée pour expliquer leur présence.
Quelques années plus tard, en 1814, l'opticien
allemand Josef von Fraunhofer remarque les
mêmes raies noires dans le spectre de la
lumière solaire. Ignorant leur signification, il
se met quant même à mesurer leurs positions
et en catalogue 324.
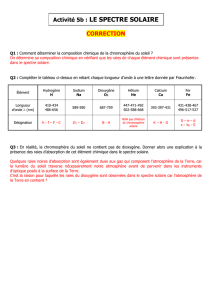
En 1859, le chimiste allemand Robert Wilhelm Bunsen (qui améliora et popularisa le brûleur qui porte
son nom) utilise un moyen d'analyse plutôt original : il introduit des sels minéraux dans la flamme de son

S. Bourdreux – Initiation à l’astronomie 2
brûleur et observe les couleurs générées par le gaz produit. Il parvient ainsi à déduire si un constituant est
présent ou non dans un minéral en observant la couleur qui, selon lui, le caractérise.
Gustav Robert Kirchhoff, un physicien allemand et ami de Bunsen, propose plutôt de disperser la lumière
produite par le gaz avec un prisme de façon à générer un spectre. Les deux chercheurs font alors une
découverte majeure : ils constatent que chaque élément chimique génère une série de raies spectrales qui
le caractérise de façon unique, comme une empreinte digitale.
Une nouvelle technique analytique, la spectroscopie, vient ainsi d'être inventée et, grâce à elle, plusieurs
nouveaux éléments chimiques sont découverts dans les années qui suivent.
S'intéressant alors au spectre de la lumière solaire, Kirchhoff constate que les raies noires de Fraunhofer
correspondent exactement à des raies brillantes émises par certains éléments chimiques. Il comprend alors
que la lumière blanche produite depuis la surface chaude du Soleil est en partie absorbée par certains
éléments chimiques présents dans son atmosphère qui elle, est plus froide, ce qui génère les raies noires.
Poussant plus loin ses recherches, Kirchhoff déduit qu'il existe trois types de spectres :
Le spectre continu, produit par un solide ou un gaz chaud et opaque ; c'est un spectre composé d'un
étalement de couleur continu allant du rouge au violet. C'est le cas d'un fer chauffé à blanc ou de la
surface d'étoiles ayant très peu ou pas d'atmosphère, comme certaines naines blanches ou les restes de
supernovae (pulsars).
Le spectre d'émission, produit par tout gaz chaud et transparent ; c'est un spectre composé de raies étroites
et brillantes de lumière sur un fond noir, lesquelles sont caractéristiques des éléments chimiques contenus
dans le gaz. C'est le cas d'un gaz produit par un brûleur ou d'une nébuleuse, par exemple. Une nébuleuse
n'est en effet rien de moins qu'un nuage plus ou moins chaud de gaz et de poussières.

S. Bourdreux – Initiation à l’astronomie 3
On distingue toutefois les nébuleuses diffuses (ou régions HII, poches de gaz contenant principalement de
l’hydrogène ionisé) et les nébuleuses planétaires (issues de la fin de vie d’une étoile)
Messier 42, la célèbre nébuleuse diffuse de la constellation d’Orion Messier 17, la nébuleuse diffuse Oméga dans la constellation
du Sagittaire
Le spectre d'absorption, où un gaz froid et transparent absorbe une partie de la lumière émise par une
source chaude émettant un spectre continu, ce qui produit dans ce dernier une série de raies noires
caractéristiques des éléments chimiques présents dans le gaz froid.
Certaines nébuleuses, dites à absorption, présentent ce type de spectre. C’est le cas de Barnard 33, la
nébuleuse de la Tête de Cheval, dans la constellation d’Orion.
NGC 7293, la nébuleuse Helix, est une magnifique
nébuleuse planétaire à 650 a.l. de nous (c’est la plus
proche), dans la constellation zodiacale du Verseau.

S. Bourdreux – Initiation à l’astronomie 4
Grâce à ces découvertes, Kirchhoff ouvre toutes grandes les portes de la spectroscopie à l'astronomie.
Pour leur plus grand bonheur, les astronomes sont désormais capables de connaître la composition
chimique des étoiles et des nébuleuses et même, en mesurant l'intensité des différentes raies spectrales et
en employant quelques notions de physique, d'en déterminer la température, la distance, la vitesse et l'âge.
Ainsi, la lumière nous permet donc en quelque sorte de « toucher aux étoiles », chose que plusieurs
pensaient impossible compte tenu des distances qui nous en séparent.
Un problème demeure cependant sans réponse pour Kirchhoff : il n'arrive pas à expliquer comment la
matière peut émettre ou absorber de la lumière. D'autres chercheurs parviendront à résoudre l'énigme une
cinquantaine d'années plus tard.
Partie 2 : Quand la matière produit de la lumière
Tout matériau, lorsqu'il est chaud, a tendance à émettre de la lumière. On peut facilement s'en rendre
compte de nos jours avec l'élément d'une cuisinière, le filament de métal d'une ampoule électrique ou le
Soleil, par exemple.
Spectre d’un ampoule à filament de tungstène (ampoule à
incandescence)
Spectre d’une ampoule à économie d’énergie… A quoi
correspondent ces zones sombres ?
Plus le corps est chauffé, et plus le spectre obtenu s’enrichit de couleurs violettes.
À la fin des années 1800, les scientifiques observent également le phénomène en chauffant des substances
dans leurs laboratoires, mais ignorent comment l'expliquer. Ils savent néanmoins décomposer la lumière
émise par un gaz en un spectre dont les raies sont caractéristiques des éléments chimiques qu'il contient.
En 1859, le physicien allemand Gustav Robert Kirchhoff baptise d'ailleurs ce type de spectre, « spectre
d'émission ».
La nébuleuse obscure de la Tête de Cheval est constituée
d’une poche de gaz qui absorbe l’essentiel du rayonnement
d’une nébuleuse en émission, rougeâtre, située en arrière-plan
(nébuleuse IC434).
température
croissante

S. Bourdreux – Initiation à l’astronomie 5
Plusieurs chercheurs vont tenter d'expliquer comment de la matière peut générer un
spectre d'émission mais sans succès. C'est en 1900 que le physicien allemand Max
Planck va fournir une partie de la réponse.
Planck constate d'abord qu'en utilisant la physique de l'époque, il est impossible de venir
à bout du problème. Il élabore alors une théorie révolutionnaire qui va marquer rien de
moins que le début de la physique moderne et la fin de la physique qui l'a jusqu'alors
précédée.
Dans sa théorie, Planck affirme que la lumière ne peut être émise que par petits paquets
d'énergie qu'il nomme « quanta » et qu'on rebaptisera un peu plus tard « photons ». Une
telle proposition est contraire à tout ce que l'on sait de la lumière à l'époque.
En effet, la lumière est alors considérée comme une forme d'énergie continue qui se propage sous
l'apparence d'une onde électromagnétique et non comme une forme d'énergie discontinue, telle que le
suppose l'existence des photons (qui sont des particules).
Entre alors en scène le physicien allemand Albert Einstein ; nous
sommes en 1905. Non seulement donne-t-il raison à Planck, mais il va
plus loin : il propose qu'en plus de se comporter à l'occasion comme
une particule (un photon), la lumière garde un caractère ondulatoire et
qu'il faut véritablement la considérer à la fois comme une particule et
comme une onde.
De plus, Einstein établit que l'énergie d'un photon est reliée à la
longueur d'onde de sa radiation. Ainsi, selon lui, les ondes ayant de
grandes longueurs d'onde (comme la lumière rouge) transportent peu
d'énergie, tandis que celles qui ont de courtes longueurs d'onde (comme
la lumière violette) véhiculent plus d'énergie.
En 1913, le physicien danois Niels Henrik David Bohr intègre
les avancées de Planck et Einstein à son nouveau modèle de
l'atome et explique comment la matière peut émettre de la
lumière sous forme de particules. Selon Bohr, l'atome est fait
d'électrons chargés négativement qui orbitent autour d'un
noyau chargé positivement. Cependant, les orbitales des
électrons sont situées à des distances bien spécifiques du
noyau.
L'électron se trouvant sur une orbite proche du noyau a
relativement peu d'énergie; il est en effet solidement retenu
par le noyau positif qui l'attire. On devra donc lui fournir
beaucoup d'énergie pour le faire passer à une orbitale
supérieure. L'électron qui occupe une position éloignée a
quant à lui beaucoup d'énergie car, pour demeurer en orbite,
il doit compenser pour la grande distance le séparant du
noyau qui cherche à exercer sur lui sa force d'attraction. On
devra donc lui fournir peu d'énergie pour le faire passer à une
orbitale supérieure.
D'après Bohr, lorsqu'un corps est chauffé, certains de ses
électrons absorbent de l'énergie et ont tendance à passer
rapidement d'une orbitale rapprochée à une orbitale plus
éloignée du noyau atomique. Chaque électron revient ensuite
de lui-même à son orbitale d'origine, située proche du noyau,
en réduisant son contenu en énergie de façon à le faire
correspondre exactement à celui de son orbitale d'origine.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%