lire la leçon

Monsieur le Recteur,
Monsieur le Premier Ministre,
Mesdames, Mesdemoiselles, Messieurs,
En vos titres et qualités,
Chers Collègues,
Chers Etudiants,
Bienvenue à cette leçon inaugurale.
Avant tout, je voudrais remercier Monsieur le Recteur de donner l'occasion de parler de
l'enseignement et de la recherche en Biologie moléculaire qui se déroule notamment dans notre
Université. Mais tout ce dont que je vais vous parler ici ne se fait pas dans notre Université. Il y a
énormément de chercheurs brillants dans le monde et je vais vous expliquer de nouvelles approches
qu'ils proposent pour soigner différentes maladies.
Avant d'embarquer dans la Biologie moléculaire proprement dite, je voudrais vous faire un rappel
des notions de base qui vont vous aider à suivre mon exposé, sous la forme d'un petit dessin animé
qui a été réalisé pour le musée du PASS à Frameries et dont nous avons l'exclusivité spécialement
pour cette rentrée. Il dure 4 minutes 20 secondes.
« Avant de venir ici, vous avez peut-être fait un tour au jardin des plantes, regardé les animaux de la
ménagerie et les arbres. Avez-vous remarqué que vous avez un air de famille avec eux? Ça ne saute
pas aux yeux et pourtant, vous êtes comme les animaux et les végétaux, fabriqués avec des unités de
base identiques: les cellules.
Des cellules, il y en a dans tout ce qui vit sur terre. Elles n'ont pas toutes la même mission mais elles
sont toutes constituées des mêmes matériaux élémentaires et fonctionnent selon les mêmes grands
principes. Une cellule est composée de cytoplasme entouré d'une membrane et contient un noyau.
C'est dans ce minuscule noyau que se trouve toute l'information qui fait que vous êtes vous et non pas
une girafe, ni un chêne, ni même votre voisin.
Le noyau contient les chromosomes qui sont le support de l'information génétique. Le nombre de
chromosomes varie selon l'espèce mais ce n'est pas parce que l'on a beaucoup de chromosomes que
l'on est forcément plus évolué. L'homme en compte 46, le mouton 54 et le maïs 22. Les chromosomes
sont de longues fibres d'ADN repliées et tirebouchonnées sur elles-mêmes.
Cette molécule d'ADN est faite de 2 brins complémentaires en forme de double hélice. C'est un peu
comme une très longue phrase qui serait la formule de vos caractéristiques personnelles.
Les mots qui la composent, ce sont les gènes. Ce sont eux qui font que vous avez 2 bras, 2 jambes et
tout le reste. Et d'infimes différences dans les gènes déterminent votre taille, la couleur de vos yeux,
de vos cheveux et tout ce qui vous est propre.
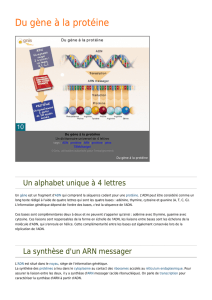
Tous les gènes sont composés à partir d'un alphabet de 4 lettres qui est le même pour l'ensemble du
monde vivant. Un gène peut contenir jusqu'à plusieurs centaines de lettres.
Comme il existe des milliers de gènes, 35 000 au total, dans chacune de nos cellules, cela donne une
énorme quantité d'informations génétiques. Environ 3 milliards de lettres pour l'homme, l'équivalent
de 1000 livres de 1000 pages et tout ça dans un tout petit noyau.
Et que fait-on avec tous ces gros livres? Comment l'organisme va-t-il mettre à exécution les
informations contenues dans les gènes en fabriquant ses propres outils: les protéines?
Et voici comment…
L'ADN envoie dans le cytoplasme un messager qui porte les mêmes secrets de fabrication. Là, il est
décodé par une tête de lecture qui traduit les instructions sous forme de protéines comme un
magnétophone qui lit une bande magnétique et produit de la musique.
Et ce sont les protéines qui vont agir, elles savent couper, coller, copier ou déformer les molécules.
Elles peuvent aussi servir de matériaux de construction. Par exemple, certaines protéines vont
participer à la constitution des tissus comme la peau et les muscles. D'autres vont vous permettre de

digérer comme les enzymes. Ce système de décodage ADN-protéines est le même pour toutes les
cellules vivantes.
Depuis le moment de la fécondation, lorsque vous n'étiez qu'une cellule, vous avez beaucoup grandi
et beaucoup changé grâce à la multiplication et la différenciation cellulaire.
Comment se fait-il que l'information génétique reste toujours la même alors que de nouvelles cellules
naissent sans arrêt? Avant que la cellule ne se divise, les 2 brins de l'hélice d'ADN se séparent et
engendrent chacun un nouveau brin complémentaire. La molécule d'ADN s'est ainsi reproduite à
l'identique et l'information reste rigoureusement la même.
Mais parfois, il y a de petits couacs dans la duplication de l'ADN. Ces variations de la formule
génétique peuvent produire des différences visibles chez une personne. Et ce sont ces différences qui
contribuent à l'évolution des espèces. »
Voici ce délicieux petit dessin animé terminé. Avez-vous remarqué dans la dernière séquence
illustrant l’évolution depuis le singe vers l’homme, que le dernier personnage dessiné est … une
femme ! Mais contrairement à ce que l'on pourrait en conclure, je voudrais rassurer les individus de
sexe masculin qui se trouvent dans cet auditoire: l'étape ultime de votre évolution n'est pas
nécessairement de devenir une femme …
Ma première diapositive présente une photo aérienne du musée de vulgarisation scientifique du
PASS à Frameries qui a été construit sur l'ancien site du charbonnage du Crachet. Deux jeunes
chercheurs de mon laboratoire et moi-même contribuons actuellement à rénover leur exposition sur
l'hérédité et l'ADN, qui date d'une douzaine d'années. En remerciement, nous avons eu l’autorisation
de vous montrer ce merveilleux petit dessin animé « La cellule en clair » réalisé sous la direction de
Joris Clerte et Philippe Briday (Gédéon et Compagnie).
Le titre de mon exposé est "De nouvelles stratégies pour traiter les maladies causées par des gènes".
Nous allons le décortiquer mot par mot pour bien le comprendre. Tout d’abord le mot « gènes ». Des
gènes, vous venez d'en entendre parler dans ce petit film. Laissez-moi vous rappeler brièvement que
notre corps est constitué d'un très grand nombre de cellules (100 000 milliards de cellules) et qu’à
l'intérieur de chacune de ces cellules, le noyau renferme les chromosomes sur lesquels se trouvent
nos gènes. Nos chromosomes et nos gènes sont constitués d'ADN, cette superbe structure en double
hélice qui a été découverte en 1953 par James Watson et Francis Crick, ce qui leur a d’ailleurs valu le
prix Nobel. Un agrandissement de cette structure, montre que les 2 brins de la double hélice sont
constitués chacun de l'enchaînement de maillons, des substances chimiques qui sont abréviées par
des lettres: A, T, G, C. Et comme dans la langue française, c'est l'ordre (la séquence) dans lequel ces
lettres s'enchainent qui détermine l'information portée par ces brins d'ADN. Observons une
particularité de cette double hélice: chaque brin est dit complémentaire de l'autre. Cela signifie
qu’en face d’un A sur un brin, se trouve un T sur l’autre brin. De même, en face d'un G sur un brin, il y
a toujours un C sur l'autre brin. Avec cette simple règle, A devant T et G devant C, s'il arrive un
accident à l’un des brins de votre ADN, votre cellule peut reconstituer le brin manquant en se basant
sur l'information sur le brin qui a survécu à l'accident. C'est un peu comme dans un ordinateur où
vous avez un disque dur et un disque supplémentaire pour les copies de sauvegarde (back-up).
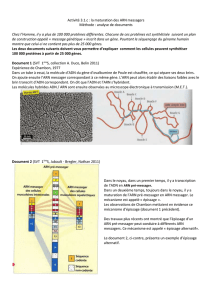
Un gène porte dans cette langue à 4 lettres la recette pour fabriquer une protéine, comme une
recette pour faire un gâteau ! Nos cellules produisent une grande variété de protéines et celles-ci
font quasiment tout dans nos cellules et notre corps, dont elles constituent aussi la structure. Quand
la cellule doit fabriquer une protéine, elle copie la recette de l’ADN sous la forme d'une autre chaîne,
plus courte, que l'on appelle un ARN messager. Donc une enzyme vient se coller à l’un des brins de
l'ADN et le copier. En face d’un G sur le brin d'ADN, l’enzyme enchaînera un C dans l'ARN; en face
d’un T sur l'ADN, elle mettra un A dans l’ARN. C’est la même règle simple de complémentarité que
pour les brins d’ADN. Il y a juste une petite différence entre ADN et ARN: il n'existe pas de T sur
l'ARN, il est remplacé par un U.

Pour expliquer à quoi sert l’ARN messager, reprenons la structure de la cellule. A l'intérieur du noyau
se trouvent les recettes pour fabriquer les protéines, ces recettes sont dans nos gènes, qui font
partie des chromosomes. Nous pouvons comparer nos chromosomes à des livres dans une
bibliothèque centrale, le noyau, dont ils ne peuvent jamais sortir. Quand il faudra fabriquer une
protéine dans la cellule, comme le gène ne peut voyager, il faudra copier sa recette sous forme
d'ARN messager: celui-ci pourra sortir du noyau pour aller dans le cytoplasme rencontrer la
machinerie qui fabriquera la protéine dont il porte la recette.
Très rarement, les enzymes de réparation de notre ADN laissent passer une erreur, comme une faute
de frappe dans un texte. S'il y a une erreur sur un gène, ce qu’on appelle une mutation, quand l'ARN
messager sera produit par copie du gène, il va également porter cette mutation. L’ARN messager
portant la recette erronée va sortir du noyau, et va diriger la fabrication d'une protéine qui elle-
même sera erronée. Par exemple la protéine sera tronquée à la moitié de sa taille normale si la
mutation vient interrompre la recette en son milieu.
Revenons au titre de mon exposé, j’y mentionne de nouvelles stratégies pour guérir les maladies.
Mais quelles étaient les anciennes stratégies en fait? Mon collègue Jean-Marie Colet, professeur de
Toxicologie, m’a signalé que tous les médicaments actuellement sur le marché, ciblent uniquement
des protéines: les antibiotiques, les antidépresseurs, les antidouleurs, les anti-cholestérol, la pilule
anti-conceptionelle etc… Pris tous ensemble, les médicaments actuels ciblent exactement 483
protéines.
La méthode du futur, ça sera plutôt d'essayer de corriger l'erreur, la mutation sur le gène, ce que
l'on appelle la thérapie génique. Mais ça, c'est encore en grande partie du rêve… A l'heure actuelle,
ce n’est pas encore tout à fait au point, même si, et c’est extraordinaire, quelques patients ont déjà
été guéris. Mais rassurez-vous, d'ici une dizaine d'années c'est sûr que ça va marcher pour plusieurs
maladies.
Alors, en attendant que reste-t-il à faire? Entre les gènes et les protéines, c'est de cibler les ARN
messagers, ces copies des recettes qui sortent du noyau pour faire fabriquer la protéine. Voici la
première stratégie qui cible les ARN messagers, c'est ce que l'on appelle l'interférence par ARN.
La découverte de ces méthodes a valu à ses auteurs Andrew Fire et Craig Mello de recevoir le Prix
Nobel de Physiologie et Médecine en 2006. Quel en est le principe? Un micro ARN, c’est-à-dire un
tout petit ARN double brin synthétique est injecté dans la cellule, il va s’associer avec plusieurs
protéines, et perdre l’un de ses brins. Le brin associé aux protéines va se coller à l'ARN messager dont
un bout de séquence lui est complémentaire et va causer la destruction de cet ARN messager.
Voyons l’impact de la méthode d'interférence par ARN au niveau de la cellule complète.
Nous partons toujours d’un gène, qui est la recette, vers l'ARN messager, qui en est la copie, et la
protéine qui est en quelque sorte le gâteau fabriqué à partir de cette recette. L'interférence ARN va
détruire l'ARN messager et, par conséquent, la cellule ne saura plus comment fabriquer la protéine.
Donc, si une protéine cause une maladie, on ne va pas cibler son gène avec ces nouvelles stratégies
thérapeutiques. On va simplement détruire l'ARN messager pour l’empêcher de porter la recette de
la protéine à l’endroit de sa fabrication !
Revenons au titre de mon exposé, j’y mentionne des maladies causées par des gènes. Qu’avons-nous
comme exemples de maladies qui pourraient être soignées de cette manière ?
Le cas le plus avancé au niveau développement thérapeutique est la dégénérescence maculaire liée à
l'âge. Cette pathologie est la cause principale de cécité dans les pays occidentaux. A quoi ressemble
la vision d'une personne qui développe cette maladie? Vous pouvez voir à gauche cette image nette
de deux enfants et d’un ballon. Mais une personne atteinte de la pathologie verra une espèce de
trou gris au milieu de l'image, avec un halo flou.

Quelle est la cause de ce problème? Voici une représentation d'une coupe d'un œil avec le cristallin,
à travers lequel la lumière va entrer. En rouge, voici la rétine où se trouvent les récepteurs qui
peuvent détecter les variations de lumière et de couleurs. Dans cette rétine que l'on a représentée ici
étalée, la macula est la zone de plus grande sensibilité à la lumière, qui va donner la vision la plus
précise. Cette rétine doit être alimentée par de l'oxygène, par des nutriments apportés par les fins
vaisseaux sanguins qui viennent l'irriguer.
La dégénérescence maculaire est causée par la production en trop grande quantité d'une protéine, le
VEGF (vascular endothelial growth factor). C'est un facteur de croissance qui permet de fabriquer des
vaisseaux sanguins, et s’il est trop abondant, il induira la croissance d’un excès de vaisseaux sanguins
dans la rétine. Ces vaisseaux sanguins seront en partie de mauvaise qualité, ce qui va causer des
saignements. Et tout cela viendra occulter cette zone tellement sensible à la lumière qui va donc
donner cette mauvaise vue.
Quelle est cette stratégie thérapeutique tout à fait innovante?
Le médecin mettra dans l'œil de la patiente des gouttes contenant l'ARN interférent, ce petit ARN qui
viendra causer la destruction de l'ARN messager du VEGF. Par conséquent, la protéine VEGF ne sera
plus fabriquée et ne causera plus cette prolifération anormale de vaisseaux sanguins à l'intérieur de
la rétine. Ce nouveau médicament a passé avec succès les étapes des essais cliniques de phase 1 et 2,
et on peut s’attendre à le trouver sur le marché dans les toutes prochaines années.
Selon un inventaire qui date de la fin 2011, cette stratégie d'interférence ARN est testée sur 20 ARN
messagers différents. Je voudrais tout de suite rassurer Valéry Saint-Ghislain qui est le grand
gestionnaire de cette séance académique: je ne vais pas parler des 20 autres exemples !
Je vous les cite en vrac… Il y a en test des micro ARN pour cibler des virus et permettre de lutter
contre des infections virales. C'est notamment une stratégie très prometteuse dans le cas de
l'infection par le virus du SIDA. Certains cancers sont causés par des mutations, des erreurs dans des
gènes, et des chercheurs ont conçu des micro ARN pour cibler les ARN messagers de ces gènes
mutés. Ils espèrent empêcher ces ARN de produire la protéine qui favorise le développement du
cancer. Une autre cible concerne des cas d'hypercholestérolémie Vous savez que l'excès de
cholestérol augmente fortement le risque de développer des maladies cardio-vasculaires. Des
chercheurs ont développé un micro ARN pour empêcher la production d'une protéine qui aggrave ce
problème.
Avant de passer à la 2ème et dernière grande famille de ces molécules de stratégie thérapeutique
nouvelle, il faut que je vous signale un petit point de nomenclature lié à la structure chimique de
chaque chaîne d’ADN: dans la double hélice, où les 2 brins sont complémentaires, on dit que l'un des
brins est dans l'orientation « sens » et l'autre « anti-sens ». Cette nomenclature sens/anti-sens est
utilisée quand 2 brins d'ADN ou 2 brins d'ARN vont se coller l'un à l'autre.
Maintenant que vous savez ce que signifie « anti-sens », je peux vous parler de la seconde stratégie
thérapeutique qui est le « saut d'exon ». Les chercheurs utilisent des oligonucléotides anti-sens,
c’est-à-dire des petits morceaux d'ADN ou d'ARN simple brin qui pourront se coller sur une partie
d’un d'ARN messager de séquence complémentaire. Cette liaison obligera l'ARN messager à former
une boucle bien précise qui sera coupée par des enzymes de la cellule. Comme l'ARN messager
perdra un morceau, la recette qu'il porte sera amputée et la protéine fabriquée sera plus courte. En
général, elle aura perdu un morceau quelque part dans le milieu.
Pour comprendre l'intérêt de cette stratégie, il faut aller jusqu’à la dernière étape de l'expression
d'un gène, quand l’ARN messager porte la recette depuis le noyau jusqu'à l'usine qui va fabriquer la
protéine. Cette usine s'appelle le ribosome et est représentée par ces 2 structures joufflues. C’est
dans le ribosome que la recette est lue pour fabriquer la protéine. La protéine est aussi une longue
chaîne, mais elle est fabriquée avec 20 unités différentes possibles que l'on appelle les acides

aminés. L'ordre dans lequel s'enchainent les acides aminés lors de la fabrication de la protéine est
déterminé par l'ordre dans lequel s'enchainent les 4 lettres dans la recette portée par l'ARN
messager.
Comment la cellule peut-elle convertir cette langue à 4 lettres de l'ARN messager en la langue à 20
lettres de la protéine ? C'est comme pour traduire de l’anglais en français, il faut un dictionnaire.
Dans la cellule l'ARN est lu par groupes de 3 lettres, et chaque « mot » de 3 lettres définit l’un des 20
acides aminés dans la protéine. Si la recette portée par l'ARN messager a perdu une lettre, ça va être
la catastrophe parce qu'elle aura perdu ce que l'on appelle sa phase de lecture, c'est-à-dire l'ordre
dans lequel ces mots de 3 lettres sont lus. Il faut qu'ils s'enchainent régulièrement : si on décale
d’une ou deux lettres, les mots seront différents sur l’ARN messager et les acides aminés différents
dans la protéine, ce qui va changer sa fonction.
L'application la plus spectaculaire de ces stratégies du « saut d'exon » est actuellement en cours
d’essais thérapeutiques dans la dystrophie musculaire de Duchenne.
Cette diapositive présente un petit garçon en fauteuil roulant : il est atteint de cette maladie
génétique. Pourquoi un garçon? Parce qu'un garçon sur 3.500 à la naissance, est atteint de cette
maladie gravissime. L'espérance de vite à l'heure actuelle ne dépasse pas 25 à 30 ans. Que se passe-t-
il dans cette maladie? Un gros plan sur une cellule de muscle montre à l'intérieur du cytoplasme des
espèces de gros tuyaux, c'est en réalité la machinerie responsable de la contraction musculaire. Elle
est constituée de protéines qui coulissent les unes sur les autres pour que le muscle se contracte. Par
la suite, le coulissement des protéines s’inversera pour relâcher le muscle. Cette contraction
développe une telle force mécanique qu’elle doit se faire en position parallèle avec la membrane. Si
elle prend une autre orientation, elle va déchirer la membrane. Pour éviter ce problème, une très
grande protéine nommée dystrophine se lie d’un côté à des protéines attachées à la membrane, et
de l’autre à des protéines attachées à l'appareil contractile. Cette protéine géante oriente la
contraction pour éviter ces déchirures musculaires. Les enfants atteints de la dystrophie de
Duchenne ont perdu un morceau du gène de la dystrophine, et par conséquent soit la protéine qui
est fabriquée est non fonctionnelle, soit elle n’est pas produite du tout, selon la mutation.
Je vous ai caché quelque chose jusqu’ici et c'est la dernière chose compliquée que je vais vous
présenter. En réalité, les recettes des protéines, qui sont portées par les gènes, ne sont pas écrites
d'une traite. Elles sont interrompues. C'est un peu comme si vous preniez une recette dans un
magazine et que vous voyiez votre recette interrompue par des placards publicitaires. Ceux-ci sont
appelés les introns et la recette est portée par des segments qu'on appelle des exons. Le gène est
donc fait de l'alternance entre exons et introns.
Lorsque cette recette morcelée est utilisée, elle est copiée sous la forme d'un précurseur de l’ARN
messager qui doit subir une étape de maturation qu'on appelle épissage. L'épissage consiste à
enlever ces petits bouts de publicité qui ne servent à rien par rapport à la recette. Chaque intron
forme une boucle qui sera clivée à sa base des 2 côtés. Les enzymes qui coupent les introns recollent
aussi les morceaux d'exons voisins les uns aux autres pour former un ARN messager qui porte la
recette d'une traite, sans interruption, pour pouvoir fabriquer la protéine.
Le gène de la dystrophine est le plus long gène humain, avec 79 exons, et son immense copie sous
forme d’ARN messager doit subir toutes ces étapes d'épissage. Sur ces diapositives, on vous montre
une petite région du messager telle qu'elle a été copiée du gène, des exons n°48 à 52. Sur l’ARN
messager, l'épissage enlève tous ces introns pour recoller les exons les uns aux autres : 48-49-50-51-
52. Ça, c'est ce qui se passe quand le gène n'est pas muté.
Que se passe-t-il chez les enfants atteints de la maladie de Duchenne ? Une partie de ces enfants ont
perdu un morceau du gène incluant l'exon n°50. Leur gène passe directement de l’exon 49 à l’exon
51. Sur l'ARN messager qui est copié à partir de ce gène muté, l'épissage va enlever les introns et
recoller les exons les uns aux autres. Mais malheureusement la fin de l'exon 49 n'est pas dans la
même phase de lecture que le début de l'exon 51. Donc, le raccord à cet endroit-là fait sauter cette
 6
6
 7
7
1
/
7
100%