Détecter l`infection précoce pour combattre la maladie

Le but de SIDABLOG est d’exposer, par le biais de lettres d’informations bimensuelles accessibles à tous,
le contenu d’articles scientifiques récemment publiés dans les plus importantes revues internationales.
Détecter l’infection précoce pour combattre la maladie
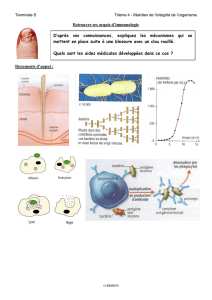
La phase qui suit la contamination par le VIH est l’infection précoce ou aiguë1. Le virus se réplique
alors efficacement et la charge virale est au plus haut un mois après l’infection, puis décroit lorsque la
réponse immunitaire se met en place. Au cours de cette phase, le risque de contagion est maximal alors
que les tests de dépistage usuels ne permettent pas de révéler la présence du virus. On se demande
aujourd’hui comment on pourrait agir sur cette première phase pour améliorer le traitement du patient et
réduire le risque de transmission.
La plupart du temps, le virus rentre dans l’organisme par voies sexuelles. Il doit tout d’abord
traverser la barrière des muqueuses. Le virus est ensuite au contact des cellules dendritiques qui le
transportent alors vers les régions où elles transmettent l’infection aux lymphocytes T CD4+ (LT CD4+).
Ces cellules infectées participent finalement à sa dissémination en rejoignant les tissus lymphoïdes
intestinaux avant que le VIH n’apparait partout dans le sang2.
Suite à l’infection, la réponse immunitaire va progressivement se mettre en place. D’abord la réponse
immunitaire innée : Elle se traduit par une expression assez forte de différents types de cytokines,
interférons, interleukines, de l’activation des LTCD4+ et des cellules NK qui tuent les cellules infectées.
Il s’ensuit une réponse immunitaire adaptative, avec une production d’anticorps reconnaissant
l’enveloppe virale. Cependant ces anticorps ne sont pas encore neutralisants et ne le deviennent qu’au
bout de 3 mois. En revanche, la réponse cytotoxique CD8+ se manifeste quelques jours avant que la
charge virale ait atteint son maximum. Elle permet de ralentir l’infection. La multiplication virale est alors
contrôlée, la quantité de virus chute, et un équilibre est maintenu entre le système immunitaire et le virus.
C’est la phase chronique de l’infection.
Toutefois, pendant la phase aiguë de l’infection, Les symptômes ne sont pas assez spécifiques pour
l’établissement d’un diagnostic3. Le virus ne pas être détecté dans le plasma pendant 7 à 21 jours. On
parle de « phase d’ellipse ». A partir d’une à 5 copies du génome viral par ml de plasma, on peut détecter
le virus par des méthodes d’amplification alors qu’à partir de 50 copies, on le détecte par les méthodes
conventionnelles de mesure de la charge virale. On parvient maintenant, grâce à des tests de diagnostic de
quatrième génération, à réduire encore de quelques jours la phase d’ellipse pendant laquelle les tests de
séropositivité ne pouvaient pas être pratiqués.
Puisque c’est au cours de cette phase d’infection aiguë que les risques de contamination sont les plus
importants4, il est nécessaire de développer des stratégies de prévention avant ou juste après la
transmission. On pourrait fournir des antiviraux à des personnes à risque avant ou immédiatement après
l’exposition au virus. En effet, des récentes études ont montré qu’un gel à base de tenofovir réduit la
transmission de 39% chez les femmes5. De même, la prise orale journalière de tenofovir et emtricitabine
la réduit de 44%6. Les travaux en cours et de nouvelles combinaisons de médicaments devraient améliorer
l’efficacité des traitements préventifs.
1 Appelée également primo-infection.
2 Il est important de noter que de manière étonnante généralement un seul des virus transmis est responsable de l’infection.
3 Les symptômes de la phase aiguë sont peu spécifiques sous forme d’un syndrome pseudogrippal, ou mononucléosique.
4 Les risques de transmission par des personnes en phases aiguë de l’infection sont 10 fois supérieurs à ceux des autres
patients.
5 Voir lettre SIDABLOG n° 42.
6 Voir lettre SIDABLOG n° 47.
Lettre bimensuelle n° 61 (16-30 juin 2011)

4 à 8 semaines
Comme ces traitements doivent être pris régulièrement par des personnes exposées, il est également
nécessaire de développer des stratégies d’accompagnement. Tel est le cas par exemple avec ces tests de
quatrième génération permettant une détection précoce et ainsi une prise en charge plus rapide du patient.
Il faut également assurer une forte prévention des réseaux sexuels existant souvent autour de patients dans
le but de diminuer la progression de l’infection auprès des populations à risque. Et enfin, il est nécessaire
de repérer ceux qui viennent d’être infectés de sorte qu’ils puissent accéder au plus vite aux traitements
adéquats.
Les événements se produisant au moment de l’infection aiguë sont déterminants pour le devenir du
patient et la prolifération du virus. Il est donc essentiel de poursuivre les recherches afin de détecter au
plus vite les nouveaux cas infectés. Cà serait une manière de réduire enfin le nombre de personnes
infectées dans le monde.
Acute HIV-1 Infection. Cohen MS, Shaw GM, McMichael AJ, Haynes BF. N Engl J Med. 2011 May
19;364(20):1943-54.
De nouveaux vecteurs viraux pourraient contrôler l’infection
Un des obstacles à la conception d’un vaccin est de maintenir une réponse immunitaire anti-VIH
efficace au niveau des muqueuses. Elles constituent les barrières naturelles par lesquelles le VIH pénètre
dans l’organisme lors d’une contamination par voie sexuelle7. Cependant, c’est durant les premiers jours
de l’infection et avant la dissémination dans l’organisme que le virus semble le plus vulnérable. Mais les
vaccins actuels sont inefficaces parce qu’ils n’agissent pas assez longtemps au niveau des muqueuses.
Des chercheurs proposent aujourd’hui un vaccin capable d’opérer dans les muqueuses, c’est-à-dire sur
des sites de réplication virale précoce.
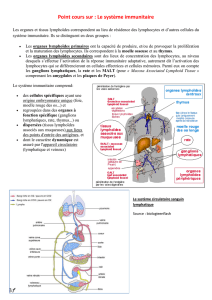
Les vaccins actuels, fondés sur des vecteurs non persistants, permettent une activation des cellules T
effectrices. Celles-ci se transformeront en lymphocytes mémoires effecteurs puis en absence de
stimulation en lymphocytes centraux mémoires. Ces derniers ont une durée de vie extrêmement longue et
sont localisés dans les tissus lymphoïdes. Ils réagiront plus efficacement contre l’élément pathogène grâce
à la stimulation vaccinale. Néanmoins, dans le cas du VIH cette réponse n’est pas assez forte, ni localisée
au niveau des muqueuses pour protéger l’organisme. Une des solutions serait de maintenir le pool de
lymphocytes mémoires effecteurs qui eux sont localisés dans les tissus périphériques, pour empêcher
qu’ils ne se transforment en lymphocytes centraux mémoires.
7 Voir lettre SIDABLOG 25.
Infection précoce
ou aigüe
Anticorps anti-VIHenv
Anticorps anti-VIHp24
LTCD8+ anti-VIH
Charge virale

Pour cela, Scott Hansen et ses collaborateurs ont développé chez le macaque des vaccins capables
d’activer et de maintenir indéfiniment des cellules T effectrices mémoires différenciées situées dans des
sites de réplication précoce. Ces vaccins sont fondés sur des vecteurs de rhésus cytomégalovirus
(RhCMV) qui expriment des protéines du VIS8, l’équivalent du VIH chez le singe. Les chercheurs les ont
testés sur des macaques qui ont été ensuite infectés par le VIS.
Ils ont montré que les animaux vaccinés puis infectés9 établissent une réponse des lymphocytes T
CD8+ et T CD4+ forte et persistante permettant alors le contrôle du VIS. Ils ont en effet suivi différents
groupes infectés et vaccinés. Sur les macaques non vaccinés presque tous ont développé une forte
infection après 3 mois. Il en est de même pour les animaux traités avec un vaccin standard. En revanche,
13 des 24 animaux traités avec le vecteur RhCMV ont contrôlé l’infection. 12 de ces 13 animaux ont
montré un affaiblissement constant de la charge virale quelques semaines après l’infection, et cela
pendant une année10. De plus, on n’observe aucune déplétion de lymphocytes T CD4+ mémoires,
indiquant que la maladie n’évolue pas. Aucune production d’anticorps spécifiques de VIS n’est observée
ainsi qu’aucune réponse cellulaire T mémoire. Ceci signifie que peu de cellules de ces macaques sont
réellement infectées.
Lymphocytes T naïfs
Tissus lymphoïdes
Très peu nombreux
Lymphocytes T effecteurs
Tissus périphériques
Très nombreux
Lymphocytes T effecteurs mémoires
Tissus périphériques
Nombreux
Lymphocytes T mémoires centrale
Tissus lymphoïdes
Peu nombreux
8 Le virus de l’immunodéficience simienne.
9 Infectés par voie intrarectale, 59 semaines après la vaccination, par la souche extrêmement pathogène VISmac239.
10 Cependant, on observe occasionnellement des rebonds de la charge virale.
Vaccin standard
Vaccin « RhCMV »
Contrôle de l’infection

Ces données indiquent que les vecteurs fondés sur RhCMV permettent un niveau de protection virale
au niveau des muqueuses, avant même que l’infection ne se soit généralisée. Ainsi, ces vecteurs
« persistants » pourraient significativement contribuer à l’élaboration de vaccins efficaces contre le VIH.
Profound early control of highly pathogenic SIV by an effector memory T-cell vaccine. Hansen SG, Ford JC,
Lewis MS, Ventura AB, Hughes CM, Coyne-Johnson L, Whizin N, Oswald K, Shoemaker R, Swanson T, Legasse
AW, Chiuchiolo MJ, Parks CL, Axthelm MK, Nelson JA, Jarvis MA, Piatak M Jr, Lifson JD, Picker LJ. Nature.
2011 May 26;473(7348):523-7.
1
/
4
100%