les bases neuronales de la mémoire ou comment les neurones

LES BASES NEURONALES DE LA MÉMOIRE
OU COMMENT LES NEURONES STOCKENT-ILS NOS SOUVENIRS ?
Jean-Bernard MANENT
Institut de Neurobiologie de la Méditerranée, INMED/INSERM U29
163, Route de Luminy, BP13
13273 Marseille cedex 09
EVOLUTION DES CONCEPTS
LES PRÉCURSEURS
Dès l’époque grecque, le désir de comprendre les mécanismes de la mémoire
passionnait déjà savants et philosophes, et certains d’entre eux avaient avancé
l’hypothèse de l’existence d’une relation entre la création d’un souvenir et un
réarrangement du cerveau. Sans s’en douter, ils avaient donné les bases du postulat
central des Neurosciences modernes, le concept de plasticité, selon lequel la
mémorisation est associée à des modifications structurales du système nerveux.
Il fallut pourtant attendre des siècles pour que le concept de plasticité soit énoncé.
Eugenio Tanzi (1893) fut le premier à proposer certaines des bases de ce concept,
sans toutefois utiliser le terme de plasticité. Il proposa que « l’activation répétée d’un
neurone conduit à des modifications métaboliques provoquant le mouvement des
prolongements de ce neurone en direction d’autres neurones, de façon à former un
lien ».
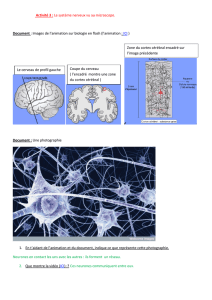
Mais c’est grâce aux théories énoncées par Cajal et
Sherrington que l’histoire moderne de l’association entre
plasticité et mémoire débute réellement. Santiago
Ramon y Cajal (Nobel 1906, figure 1), qui a profité de la
découverte par Camillo Golgi (1873, Nobel 1906) de la
reazione nera, une coloration au nitrate d’argent
permettant la visualisation des cellules nerveuses, fournit
les supports anatomiques à l’élaboration de la théorie
neuronale par Waldeyer. Avant les travaux de Cajal, le
Système Nerveux était considéré comme un réseau
continu de "nerfs", formé par les branches anastomosées
des prolongements des cellules nerveuses : c’était la
vision "réticulariste". La vision "neuroniste" ou "théorie
neuronale" introduite par Heinrich Wilhelm Gottfried
Waldeyer (1891) est centrée sur la cellule nerveuse, qu’il
baptise "neurone". Dans sa publication (1891) Waldeyer
propose que « le système nerveux est constitué
d’innombrables unités nerveuses (les neurones), qui sont
anatomiquement et génétiquement indépendantes les
unes des autres. Chaque unité nerveuse est composée
de trois parties : un corps, une fibre et des branches
terminales. » En 1894, Cajal introduit une théorie
concernant le stockage de la mémoire, selon laquelle
l’information serait stockée grâce à des modifications
anatomiques des connexions entre les cellules
nerveuses. Selon lui, « l’exercice mental n’est pas
capable d’améliorer l’organisation cérébrale en augmentant le nombre de cellules,
mais plutôt en favorisant le développement de l’appareil dendritique et du système de
collatérales axonales dans les régions cérébrales les plus utilisées. En ce sens, les
associations déjà établies parmi certains groupes de cellules seraient
significativement renforcées par la multiplication des petites branches terminales de
Figure 1. Santiago Ramón y Cajal dans son
laboratoire. Photo Institut Cajal, Madrid

l’arborisation dendritique et des collatérales axonales ; mais, de plus, des connexions
intercellulaires totalement nouvelles pourraient être établies, grâce à la formation de
nouvelles collatérales axonales et de nouvelles dendrites. » Les bases
morphologiques du concept de plasticité sont ainsi établies.
En 1897, Sir Charles Scott Sherrington (Nobel 1932) introduit le concept de
synapse, comme « les points de contact entre les cellules nerveuses, où une cellule
nerveuse agit sur une autre ». Les bases de la communication entre les neurones
sont ainsi posées, mais les théories révolutionnaires énoncées par ces auteurs furent
pratiquement ignorées au cours des soixante années qui suivirent leurs publications,
et ne commencèrent à être revisitées qu’à la fin des années 1940 et au début des
années 1950.
EVOLUTION DES CONCEPTS
LES AVANCÉES TECHNIQUES
A cette période, les techniques électrophysiologiques d’enregistrements
intracellulaires apparaissent, permettant une analyse des propriétés synaptiques des
neurones. De plus, l’identification et l’analyse fine de l’ultrastructure synaptique est
permise grâce aux progrès de la microscopie électronique, technique mise au point
par Max Knoll et Ernst Ruska (1932, Nobel 1986). L’existence anatomique et
fonctionnelle des synapses est ainsi démontrée. Quelques auteurs entre-temps
affinent les bases de ces théories.
Parmi eux, Donald Hebb (1949) introduit une théorie, qui sera dénommée par la suite
« loi de Hebb » (figure 2). Selon celle-ci, la force de la connexion (synaptique)
présente entre deux neurones est augmentée durablement lorsque la décharge du
neurone pré-synaptique (en amont de la synapse) est fortement corrélée
temporellement à celle du neurone post-synaptique (en aval de la synapse). En
d’autres termes, la force de la synapse existant entre deux neurones se trouve
renforcée si ces neurones sont simultanément actifs : on parle de renforcement
synaptique. Ce renforcement synaptique peut être positif, augmentant ainsi la force de
la connexion, on parle alors de facilitation de la transmission synaptique (ou
potentialisation). Au contraire, si ce renforcement est négatif, on parle alors d’inhibition
synaptique (ou dépression). Ces deux termes, potentialisation ou dépression, entrent
dans le cadre large de la plasticité synaptique. La loi de Hebb introduit également le
concept d’une modification structurale ou métabolique, que certains auteurs qualifient
de "composant de Hebb".
Figure 2. La loi de Hebb. "When an axon of cell A is near enough to excite B and repeatedly or persistently takes part in
firing it, some growth process or metabolic change takes place in one or both cells such that A's efficiency, as one of
the cells firing B, is increased" Hebb, D. O. The Organization of Behavior: a Neuropsychological Theory (Wiley, New
York, 1949).

A la même période, Jerzy Konorski (1948) propose que la plasticité synaptique,
induite par l’association de stimuli répétés, peut être liée à la transformation de
connexions synaptiques potentielles en connexions synaptiques fonctionnelles, à la
suite de modifications morphologiques. Aujourd’hui, la théorie de Hebb-Konorski,
comme base du lien entre mémoire et plasticité synaptique, est largement acceptée
par la communauté scientifique. Avant d’être acceptées, ces théories ont néanmoins
dû être validées au plan expérimental.
EVOLUTION DES CONCEPTS
LES BASES EXPÉRIMENTALES
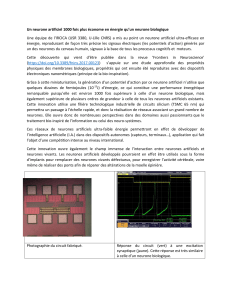
Le réflexe de rétraction branchiale chez l’Aplysie.
Le mollusque marin Aplysia Californica, est un modèle de choix pour l’étude de la
plasticité synaptique. Les neurones du système nerveux central de cet animal sont
peu nombreux, de grande taille, aisément identifiables au plan morphologique et sont
situés à des emplacements invariants. L’équipe d’Eric Kandel (1973, 1978, Nobel
2000) a particulièrement étudié l’un des réflexes moteurs de cette limace de mer, le
réflexe de rétraction branchiale, qui lui permet de rétracter son organe respiratoire ou
branchies, à la suite de la stimulation de la peau qui recouvre le siphon de l’organe, le
manteau (figure 3). L’aplysie présente deux formes simplifiées d’apprentissage,
qualifiées d’habituation et de sensibilisation.
Lorsqu’on applique régulièrement des stimuli non douloureux au niveau du manteau,
l’amplitude du réflexe de rétraction branchiale de l’animal diminue progressivement :
c’est l’habituation. L’animal apprend à ne plus répondre à ces stimuli devenus
Figure 3. Habituation et sensibilisation du réflexe de rétraction branchiale chez l’Aplysie. L’application successive
de stimuli non douloureux au niveau du manteau provoque une diminution de l’amplitude du réflexe de rétraction
branchiale : c’est l’habituation. Après habituation, une forte stimulation de la queue provoque une très forte
augmentation de l’amplitude du réflexe : c’est la dés-habituation. Par la suite, une stimulation non douloureuse du
manteau provoque une réponse exacerbée : il y a eu sensibilisation.

insignifiants, sa réponse est devenue habituée. Après cette période d’habituation,
l’application d’une forte stimulation au niveau de la queue de l’animal augmente
fortement l’amplitude du réflexe de rétraction branchiale : cette réponse exacerbée est
une réponse sensibilisée, il y a eu dés-habituation (figure 3). L’animal présente alors
une forme de crainte apprise : après avoir appris à ne plus se soucier de stimuli
anodins, l’application de ce stimulus douloureux lui fait répondre par la suite de façon
exagérée à d’autres stimuli anodins. Cette mémoire d’une expérience douloureuse
persiste si elle est renouvelée : la crainte de l’expérience douloureuse et sa mémoire
associée sont renforcées par la répétition. Une seule expérience douloureuse donnera
une mémoire qui durera quelques minutes, mais plusieurs expériences douloureuses
espacées dans le temps donneront naissance à des mémoires plus durables,
persistant jusqu’à plusieurs jours.
Les mécanismes de ce comportement d’apprentissage ont été disséqués au plan
cellulaire. Les neurones impliqués ont été identifiés précisément. Ils sont situés au
niveau du ganglion abdominal et sont organisés en un réseau composé de vingt-
quatre neurones sensoriels mécano-sensibles qui innervent la peau du siphon et
établissent des connexions monosynaptiques avec six neurones moteurs contrôlant
les muscles des branchies. Les neurones sensoriels établissent aussi des connexions
indirectes avec les neurones moteurs par l’intermédiaire d’un petit groupe
d’interneurones modulateurs (figure 4).
Le neurotransmetteur sérotonine est l’acteur clé du système : il active des récepteurs
spécifiques et une cascade de signalisation intracellulaire, qui va rendre les neurones
sensoriels plus excitables et capables de répondre de façon prolongée. C’est la
sérotonine libérée par les interneurones modulateurs qui, agissant au niveau des
récepteurs spécifiques portés par les neurones sensoriels, va moduler leur excitabilité
et la quantité de neurotransmetteurs qu’ils vont libérer. La synapse existant entre les
neurones sensoriels et les neurones moteurs contrôlant les muscles des branchies va
ainsi être renforcée : on parle de facilitation synaptique. Les neurones sensoriels
répondront plus facilement et avec une amplitude plus élevée lors d’un stimulus
douloureux et activeront de façon intense les neurones moteurs. La contraction des
muscles des branchies, qui sont commandés par les neurones moteurs, sera donc
plus intense. Ces mécanismes sont responsables de la mémoire à court terme. A plus
long terme, il va y avoir modification de l’expression des gènes au sein des neurones
sensoriels et création de nouvelles connexions nerveuses entre les neurones
Figure 4. Habituation et sensibilisation du réflexe de rétraction branchiale chez l’Aplysie, réseau neuronal simplifié.
Lors d’une stimulation douloureuse de la queue, le neurone sensoriel (NS1) active un interneurone modulateur
(MOD). L’interneurone modulateur libère de la sérotonine, qui va activer des récepteurs spécifiques portés par le
neurone sensoriel (NS2). La sérotonine a 2 effets au niveau du neurone sensoriel NS2 : 1) à court terme, elle va
modifier son excitabilité et augmenter la quantité de neurotransmetteurs (NT) qu’il peut libérer : la synapse existant
entre NS1 et le neurone moteur (NM) est renforcée. La contraction des muscles des branchies sera donc plus
intense. 2) à long terme, elle va modifier l’expression des gènes et permettre la création de nouvelles connexions
nerveuses.

sensoriels et les neurones moteurs, permettant une facilitation durable de la
transmission de l’information.
Les données obtenues grâce à l’étude de cet apprentissage simple ont permis
d’affiner la compréhension et la conceptualisation des mécanismes de mémorisation.
Ces stratégies de stockage des informations impliquent à court terme un renforcement
synaptique et à plus long terme une modification de l’expression des gènes et la
création de nouvelles connexions. Des mécanismes similaires conservés au cours de
l’Evolution pourraient être impliqués dans la mémorisation chez les vertébrés
supérieurs et chez l’Homme.
La potentialisation à long terme chez les vertébrés
Chez les mammifères et chez l’Homme, l’hippocampe est considéré comme l’une des
structures cérébrales indispensables
à la mémorisation. L’importance de
cette structure a été soulignée par
l’étude clinique de patients ayant
subi des lésions des lobes
temporaux cérébraux. Le patient H.
M., décrit par William Scoville et
Brenda Milner (1957), avait subi
une ablation bi-latérale des
hippocampes dans le but de soigner
une épilepsie sévère du lobe
temporal. Cette opération, qui l’avait
guéri de son épilepsie, avait
provoqué un déficit de mémorisation
très important : perte totale des
souvenirs récents et incapacité d’en
stocker de nouveaux. Depuis cette
étude, l’hippocampe est identifié
comme une structure cérébrale
indispensable à la mémorisation (et
les résections de l’hippocampe dans
la chirurgie de l’épilepsie sont
uniquement uni-latérales).
La potentialisation à long terme
(LTP) est le mécanisme candidat
expliquant la mémorisation. Il s’agit
d’un renforcement synaptique de
longue durée, déclenché par des
stimulations synaptiques de nature
particulière. Cette LTP a été étudiée
au niveau de la région CA1 de
l’hippocampe par Timothy Bliss et
Terje Lomo (1973). Ces auteurs ont
démontré que les synapses de
l’hippocampe avaient des propriétés
de plasticité remarquables, qui
pourraient être du type de celles
requises pour le stockage des
informations en mémoire.
En particulier, une stimulation par
train de potentiels d’action au sein
d’une des trois voies de
communication nerveuse dans
l’hippocampe produit une LTP : un
renforcement synaptique de longue
durée dans la voie activée (figure 5),
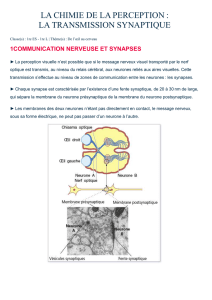
Figure 5. La potentialisation à long terme au niveau de
l’hippocampe
a) Coupe d’hippocampe chez le rat : Les voies de communication
sont représentées en vert (comm : voie commissurale, Sch :
collatérales de Schaffer, pp : voie perforante, mf : fibres
moussues), les régions de l’hippocampe sont identifiées (CA1,
CA2, CA3, DG). Les électrodes d’enregistrement permettent de
mesurer l’activité unitaire d’un neurone ou d’un groupe de
neurones. L’électrode de stimulation est placée au niveau des
collatérales de Schaffer. Ici, le neurone pré-synaptique est situé au
niveau de la couche pyramidale de la région CA3. Le neurone post-
synaptique est situé au niveau de la couche pyramidale de la
région CA1. Ils communiquent par l’intermédiaire des collatérales
de Schaffer.
b) Protocole de LTP : La stimulation unitaire (1 seul potentiel
d’action, PA) du neurone pré-synaptique (Stim. neurone Pre)
provoque une réponse au niveau du neurone post-synaptique
(Enregistr. neurone Post) : c’est la réponse initiale. La stimulation
par trains de PA du neurone Pre active la synapse entre les
neurones Pre et Post. Après les trains de PA, la stimulation
unitaire du neurone Pre provoque une réponse potentialisée au
niveau du neurone Post : c’est la réponse potentialisée, il y a eu
LTP. (d’après C. Hammond, Academic Press)
 6
6
 7
7
 8
8
1
/
8
100%