Extrait du guide des analyses spécialisées Cerba

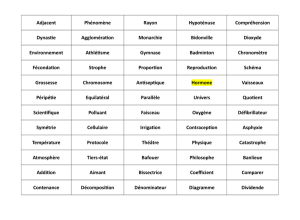
Microdélétionsduchromosome Y
On estime àprès de 10 %lafréquence du phénotype
de l’infertilité masculine dans la population humaine.
Un déficit primaire de la production des spermatozoïdes
touche environ 2%des hommes dans le monde :
•une infertilité masculine est souvent liée àundéficit
de quantité, de mobilité, de la morphologie ou du
fonctionnement des spermatozoïdes ;
•les causes de l’infertilité sont multiples :une étiologie
ne peut être identifiée que dans 50 à60%des cas
par l’examen clinique ou les examens complémen-
taires (spermogramme, biochimie, dosages hormo-
naux). Les mécanismes en cause peuvent être
anatomiques, génétiques ou environnementaux. En
l’absence d’étiologie, on parle de stérilité idiopathique.
Parmi les causes génétiques, citons pour mémoire :
•les anomalies chromosomiques (essentiellement syn-
drome de Klinefelter, mais aussi translocations, inver-
sion…) dont la fréquence est multipliée par 10 en cas
d’oligospermie inférieure à10
6
spermatozoïdes/ml ;
•les anomalies monogéniques,parmi lesquelles celles du
gène CFTR ,qui tiennent uneplaceàpart. Elles sont en
effet responsables de 80 %des azoospermiesobstruc-
trices par agénésie bilatérale descanauxdéférents, une
formemonosymptomatiquedemucoviscidose. Les
gènes codant le récepteur aux androgènes, la FSH,
la LH, l’AMH… sont plus rarement concernés ;
•les microdélétions du chromosome Y, qui sont impli-
quées dans près de 10 à15%des infertilités masculines.
Structure du chromosome Y
Le chromosome Yest le seul chromosome qui soit pré-
sent en un seul exemplaire dans le caryotype. Il est
impliqué dans deux mécanismes fondamentaux que
sont la production de spermatozoïdes et le détermi-
nisme testiculaire.
Sa structure unique est le résultat de l’évolution. Elle
consiste aujourd’hui en une région spécifiquement mâle
appelée MSY (male specific Ychromosome)qui est
située entre les régions PAR1 et PAR2 (pseudo-
autosomal region)homologues de régions situées sur le
chromosome X, qui sont àl’origine des recombinaisons
inter-chromosomiques avec le chromosome Xsurve-
nant normalement pendant la méiose masculine.
Àl’inverse, la région MSY n’est pas sujette àrecombi-
naisons intrachromosomiques. Elle comprend trois
types de séquences :
•une région X-transposée présente sur le bras court,
Guide des analyses spécialisées
homologue àplus de 99 %avec la région Xq21.2
pauvre en gène et constituée presque exclusivement
de séquences répétées de type LINE1 (long interspeed
nuclear 1);
•une région X-dégénérée, présente àlafois sur le bras
court et long, renfermant de nombreux pseudo-gènes
ainsi que 16 gènes de transcription ubiquitaire ;
•une séquence de type amplicon, représentant plus du
tiers de la région MSY euchromatique et contenant
60 membres de neuf familles de gènes d’expression
testiculaire spécifique. Sur le bras long du chromo-
some Y, les gènes sont situés au sein de palindromes,
séquences dupliquées en miroir présentant 99,9 %
d’homologie.
Le déterminisme testiculaire est sous la dépendance du
facteur TDF (testis determining factor), codé par le gène
SRY situé en position Yp11.3.
Microdélétions du chromosome Y
De découverte récente, les microdélétions du chromo-
some Ysont responsables d’anomalies de la spermato-
genèse conduisant àladeuxième cause d’infertilité
masculine après le syndrome de Klinefelter.
C’est la région MSY qui est affectée par ces délétions ;
elle est classiquement subdivisée en trois régions appe-
lées respectivement AZFa, AZFb et AZFc, donc locali-
sées en position Yq11 :
•la région AZFa s’étend sur environ 1100 kb et
contient deux gènes en copie unique :legène DFFRY
ou USP9Y, et le gène DBY. La délétion dite complète
de cette région entraîne plus de 792 kb comprenant
les deux gènes présents. Elle résulte d’une recombinai-
son homologue entre deux séquences rétrovirales de
même orientation ;
•la délétion complète de la région AZFb,qui est la
conséquence d’une recombinaison homologue entre le
palindrome P5 et le palindrome P1 proximal. Elle
conduit àladélétion d’une région de 6,2 Mb incluant
32 gènes et unités de transcription ;
•la région AZFc comprend 12 gènes et unités de trans-
cription présents chacun en plusieurs copies et repré-
sentant ainsi plus de 32 copies. C’est dans cette région
qu’on retrouve plusieurs gènes candidats de la fertilité
masculine :trois copies du gène BPYY ( basic protein
on chromosome Y, 2), deux copies du gène CDY1
( chromodomain protein Ychromosome, 2)etquatre
copies du gène DAZ ( deleted in azoospermia).Dans
sa forme complète, la microdélétion de la région
AZFc résulte de la recombinaison entre les amplicons
b2 et b4 des palindromes P3 et P1 ;une région d’envi-
ron 3,5 Mb est ainsi délétée, entraînant 21 copies de

gènes. Par ailleurs, et contrairement aux connais-
sances initiales, les régions AZFb et AZFc sont che-
vauchantes. En conséquence, la délétion totale de ces
deux régions peut également être observée en relation
avec des recombinaisons P5/P1 distal (7,7 Mb,
42 copies) ou P4/P1 distal (7 Mb, 38 copies).
Indications, corrélations génotype-phénotype,
implications thérapeutiques
Les microdélétions de l’Y sont spécifiques d’anomalies
de la spermatogenèse et ne sont jamais détectées chez
les sujets àsperme normal. Elles peuvent donc être com-
patibles avec une fertilité dans la mesure où celle-ci est
compatible avec un faible nombre de spermatozoïdes.
Il est donc préférable de conclure qu’une microdélétion
est la cause d’une azoo- ou d’une oligospermie plutôt
que d’infertilité.
Leur recherche est indiquée pour établir la cause d’une
oligo- ou azoospermie, mais également dans l’établis-
sement d’un pronostic relatif aux procédures de pro-
création assistée, en dehors des situations suivantes :
anomalie chromosomique, azoospermie obstructive,
hypogonadisme.
En l’état actuel des connaissances, les anomalies devant
être recherchées car pertinentes d’un point de vue cli-
nique sont les suivantes.
—Délétion complète de la région AZFa
(environ 3%des cas)
Elle conduit invariablement àunsyndrome complet
Sertoli-Cell-Only (SCO) et àune azoospermie, ce qui
implique l’absence de tout spermatozoïde intratesticu-
laire.
Ces patients ne doivent donc pas être candidats àbiop-
sie testiculaire TESE (testicular sperm extraction)pour
ICSI ( intracytoplasmic sperm injection).
—Délétion complète de la région AZFb
ou AZFb+c (environ 9et6%des cas)
Elle se caractérise par un arrêt de spermatogenèse ou
un syndrome Sertoli-Cell-Only (SCO) conduisant àune
azoospermie. Tout comme la délétion AZFa,ces
patients ne doivent donc pas être candidats àbiopsie
testiculaire TESE pour ICSI, car ces délétions ne sont
pas compatibles avec la présence de spermatozoïdes
intratesticulaires.
—Délétion complète de la région AZFc
(environ 79 %des cas)
C’est de loin la plus fréquente, mais aussi la plus hétéro-
gène sur le plan clinique et histologique. Elle est généra-
lement compatible avec une spermatogenèse résiduelle
et peut être parfois détectée chez des patients naturelle-
ment fertiles, bons candidats àune procréation par
ICSI.
Dans tous les cas, les parents doivent être informés que
l’anomalie sera transmise obligatoirement àladescen-
dance mâle, bien que le phénotype définitif ne soit pas
prévisible formellement.
Àcôté de ses principales catégories de microdélétions,
ont été plus récemment décrites des délétions partielles
du chromosome Y, région AZFc en particulier. Parmi
ces délétions, la délétion gr/gr est retrouvée chez 3%
des hommes infertiles. Toutefois, celle-ci est transmise
le plus souvent naturellement par leur père et pourrait
n’être qu’un simple polymorphisme sans effet sur la
spermatogenèse. D’autres types de délétions partielles
intéressant la région AZFc sont décrits. Ils ne sont pas
détectés par les méthodes classiques habituelles (voir
plus bas), mais leur impact sur le phénotype clinique
n’est pas encore très clair.
Génétique moléculaire des microdélétions
de l’Y :recommandations
Des recommandations pour la recherche des microdélé-
tions du bras long du chromosome Yont été établies
par l’Académie Européenne d’Andrologie.
Le screening de ces anomalies peut être réalisé de
manière simple par amplification génique (PCR) utili-
sant deux couples d’amorces spécifiques de régions ano-
nymes (STS :sequenced tag site)localisées dans
chacune des régions AZFa, AZFb et AZFc.
Ceux retenus sont les STSs suivants :sY84 et sY86
( AZFa), sY127 et sY134 (AZFb); sY254 et sY255
( AZFc), car dérivant de régions non polymorphes et
détectant des délétions bien connues comme étant asso-
ciées àdes infertilités en relation avec une oligo/azoo-
spermie.
En cas de mise en évidence d’une microdélétion com-
plète, une étude plus approfondie afin d’en définir les
bornes peut être envisagée. Toutefois, elle ne présente
aucun intérêt clinique dans la mesure où elle n’a aucune
incidence ni diagnostique, ni pronostique.
Par ailleurs, la détection de délétions partielles doit faire
évoquer en première intention une erreur technique
dans la mesure où ces délétions sont tout àfait excep-
tionnelles pour les régions AZFa et AFZb.Quant à
celles décrites dans la région AZFc,elles ne sont pas
mises en évidence par les tests de screening effectués en
première intention.
(Ravel C, Chantot-Bastaraud S, McElreavey K, Siffroi JP.
Polymorphismes du chromosome Yetfertilité masculine.
Gynécol Obstét Fertil 2006 ;34:885-893.

Simoni M, Bakker E, Krausz C.
EAA/EMQN best practiceguidelines formolecular diagnosis of
y-chromosomal microdeletions. Stateofthe art2004.
Int JAndrol 2004 ;27:240-249.
1
/
3
100%