Cinétique, chimie organique et acides / bases

Terminale S www.sciencesphysiques.info
Devoir de Sciences Physiques n°5 Page 1 / 6
Devoir de Sciences Physiques nÀ5
L’épreuve dure 1h50. L’usage de la calculatrice est autorisé.
Exercice I : sur le zinc…
Les précipitations sont naturellement acides en raison du dioxyde de carbone présent dans l’atmosphère.
Par ailleurs, la combustion des matières fossiles (charbon, pétrole et gaz) produit du dioxyde de soufre et
des oxydes d’azote qui s’associent à l’humidité de l’air pour libérer de l’acide sulfurique et de l’acide
nitrique. Ces acides sont ensuite transportés loin de leur source avant d’être précipités par les pluies, le
brouillard, la neige... Très souvent, les pluies s’écoulant des toits sont recueillies par des gouttières
métalliques, constituées de zinc. Le zinc est un métal qui réagit (s’oxyde) en milieu acide selon la réaction
d’équation suivante :
(l)22(g)
2
(aq)
(aq)3(s)
O2H H Zn O2H Zn ++ →+
++
1/ Suivi cinétique de la transformation
Pour étudier la transformation correspondant à l’attaque acide du zinc, on réalise l’expérience dont le schéma
simplifié est représenté sur la figure 1.
FIGURE 1
À l’instant de date t = 0 s, on verse rapidement 100,0 mL de solution d’acide sulfurique de concentration en
ions oxonium [H
3
O
+
] = 0,40 mol.L
−1
sur 0,654 g de poudre de zinc.
La formation de dihydrogène à l’état gazeux crée une surpression dans l’erlenmeyer. Les mesures de
pression effectuées à différentes dates par un capteur permettent de déterminer la quantité n(H
2
)
(g)
de
dihydrogène produit et ainsi d’en déduire l’évolution de l’avancement x(t) de la réaction au cours du temps.

Terminale S www.sciencesphysiques.info
Devoir de Sciences Physiques n°5 Page 2 / 6
1.1/ Donne la relation liant la quantité de dihydrogène produit n(H
2
)
(g)
à un instant t et la valeur de
l’avancement x(t) à ce même instant.
1.2/ Définis le temps de demi-réaction t
½
puis détermine sa valeur.
On considère généralement que, vers 6 ou 7 fois t
½
, la réaction est terminée.
1.3/ Déduis-en une estimation de la durée de la réaction.
2/ Facteurs cinétiques
2.1/ Influence de la concentration en ions oxonium
On reprend le montage de la figure 1 et on réalise les trois expériences présentées dans le tableau 1 ci-
dessous.
Pour chacune des expériences 1, 2 et 3, on a tracé sur la figure 3 les trois courbes (a), (b) et (c) représentant
l’avancement de la réaction lors des 60 premières minutes : associe, en justifiant rigoureusement, à chacune
des courbes de la figure 3 le numéro de l’expérience 1, 2 ou 3 correspondante.

Terminale S www.sciencesphysiques.info
Devoir de Sciences Physiques n°5 Page 3 / 6
2.2. Influence de la forme du zinc (division et état de surface)
On reprend le montage de la figure 1 et on réalise trois nouvelles expériences présentées dans le tableau 2 ci-
dessous.
On trace les courbes x = f(t) pour les trois expériences et on obtient le graphique de la figure 4 ci-après.
2.2.1. À partir des courbes obtenues lors des expériences 4 et 5 (fig.4) et de tes connaissances, indique quelle
est l’influence de la surface du zinc en contact avec la solution sur la vitesse de réaction.
2.2.2. En milieu humide, le zinc se couvre d’une mince couche de carbonate de zinc qui lui donne un aspect
patiné. À partir des courbes obtenues (fig.4) et de tes connaissances, indique quelle est l’influence de cette
couche de carbonate de zinc sur la vitesse de réaction.
3/ Pluies acides et gouttières
Les précipitations naturelles et non polluées ont un pH acide, leur acidité étant due au dioxyde de carbone
qui se dissout dans l’eau. En France, la concentration moyenne en ions oxonium H
3
O
+
rencontrés dans les
eaux de pluies est égale à 1,0.10
−5
mol.L
−1
.
Les trois facteurs cinétiques étudiés dans la partie 2 permettent-ils d’expliquer la longévité des gouttières en
zinc dans les habitations ? Une dizaine de ligne seront nécessaires à traiter correctement cette question.

Terminale S www.sciencesphysiques.info
Devoir de Sciences Physiques n°5 Page 4 / 6
Exercice II : suivi cinétique par chromatographies successives
Un étudiant en chimie effectue une thèse dans un laboratoire de chimie organique. Il souhaite oxyder l'alcool
A en cétone B en utilisant un oxydant appelé BAIB en présence d'un catalyseur (nommé TEMPO) :
Pour suivre l'évolution temporelle de sa réaction, il utilise la chromatographie en phase gazeuse (CPG). Il
en explique le principe : « la CPG est une technique qui permet de séparer des molécules d'un mélange. Le
mélange à analyser est vaporisé à l'entrée d'une longue et fine colonne enroulée sur elle-même (12 m de
longueur et 0,2 mm de diamètre) remplie d'un solide appelé phase stationnaire, puis il est poussé à travers
celle-ci à l'aide d'un gaz vecteur. J'utilise de l'hélium. Les différentes molécules du mélange vont se séparer
et sortir de la colonne les unes après les autres après un certain laps de temps (appelé temps de rétention)
qui dépend de l'affinité des molécules pour la phase stationnaire. À la sortie de la colonne, les molécules
sont détectées et identifiées par spectrométrie de masse. Un logiciel fournit le chromatogramme, courbe en
fonction du temps qui fait un apparaître un pic par molécule détectée ».
L’étudiant a lancé la réaction un soir (cette action
définit la date t = 0).
De retour au laboratoire le lendemain matin, il
réalise une CPG de son mélange (à t = 15h) et
décide de rajouter du BAIB.
Après 3h de réaction supplémentaire, il effectue
une nouvelle CPG (à t = 18h) et arrête sa réaction.
La figure ci-contre reproduit les chromatogrammes
qu'il a obtenus.
La spectrométrie de masse permet d'attribuer le pic
à 1,3 min à l'alcool A, celui à 1,0 min à la cétone B
et celui à 1,9 au produit C. Le composé BAIB n'est
pas détecté par cette méthode.
1/ Justifie les décisions de l’étudiant de rajouter du BAIB à t = 15h et d’arrêter sa réaction à t = 18h.
2/ Quel peut être la molécule dont le temps de rétention est de 2,4 min ? Justifie.
Exercice III : réaction d’estérification
Les esters sont des composés organiques, souvent à l'origine de l’arôme naturel des fruits. À côté de leur
production naturelle, ils sont aussi synthétisés pour satisfaire les besoins de l'industrie agroalimentaire, de
la parfumerie et d’autres secteurs industriels. Le butanoate d’éthyle est, par exemple, un ester à l’odeur
d’ananas, l’éthanoate de propyle rappelle l’odeur de la poire…
L'estérification est une transformation chimique au cours de laquelle un ester, de formule R
1
–COO–R
2
, est
obtenu par réaction entre un acide carboxylique R
1
–COOH et un alcool R
2
–OH. Il se forme aussi de l’eau
selon l’équation :
L’oxygène marqué O* de l’alcool est celui qu’on retrouve généralement dans l’ester.

Terminale S www.sciencesphysiques.info
Devoir de Sciences Physiques n°5 Page 5 / 6
Cet exercice aborde l’étude du mécanisme de la synthèse de l’éthanoate de butyle.
1/ Aspect macroscopique
1.1. Nomme et donne la formule semi-développée des deux réactifs de la réaction considérée, conduisant à la
formation de l’éthanoate de butyle.
1.2. Indique si la réaction d’estérification est une réaction de substitution, d’addition ou d’élimination.
Justifier.
2/ Aspect microscopique
Données : l’électronégativité traduit la capacité d’un atome à attirer à lui les électrons d’une liaison dans
laquelle il est engagé. L’atome d’oxygène O est beaucoup plus électronégatif que l’atome de carbone C. Les
électronégativités du carbone et de l’hydrogène H sont en revanche, voisines.
Identifie pour chacun des réactifs un site donneur ou un site accepteur de doublet d’électrons puis propose
une première étape pour le mécanisme de formation de l’ester.
Exercice IV : ibuprofène
L’ibuprofène est une molécule de formule brute C
13
H
18
O
2
.
Son nom en nomenclature officielle est : acide 2-(4-isobutylphényl)propanoïque.
De par ses propriétés anti-inflammatoire, antalgique et antipyrétique,
elle constitue le principe actif de divers médicaments. Cet exercice
comporte deux parties indépendantes conduisant à étudier la structure
de la molécule d’ibuprofène, puis ses propriétés acides et sa réaction
avec l’eau.
Partie A : la molécule d’ibuprofène
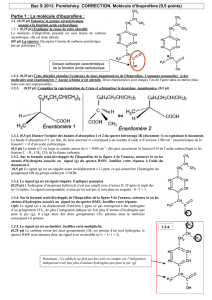
1/ Recopie la formule semi-développée de l’ibuprofène donnée ci-
contre et entoure en rouge le groupe caractéristique associé à la
fonction acide carboxylique.
La molécule d’ibuprofène est chirale.
2/ Explique la cause de cette chiralité en la nommant et repère-la en
noir sur la formule semi-développée déjà représentée.
3/ Cette chiralité entraîne l’existence de deux énantiomères de l’ibuprofène. Comment reconnaître si des
molécules sont énantiomères ? Aucun schéma n’est attendu.
4/ L’énantiomérie est-elle une isomérie de configuration ou une isomérie de conformation ? Justifie.
5/ Dans la représentation de Cram, que représentent le triangle plein et le triangle hachuré ?
6/ La représentation de Cram de l’un des deux énantiomères de l’ibuprofène est en partie fournie ci-dessous,
mais elle est inachevée. Recopie et complète cette représentation, puis schématise le deuxième énantiomère.
 6
6
1
/
6
100%