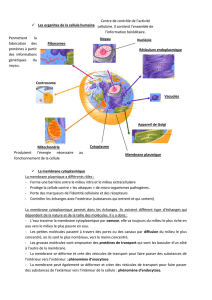
LES TRANSPORTS MOLECULAIRES

Physico-chimie Pr S SAGUEM Dr K CHATTI
2002 - 1 -
C
C
CO
O
OU
U
UR
R
RS
S
S
P
P
PC
C
CE
E
EM
M
M1
1
1
É
É
ÉL
L
LÉ
É
ÉM
M
ME
E
EN
N
NT
T
TS
S
S
D
D
DE
E
E
P
P
PH
H
HY
Y
YS
S
SI
I
IC
C
CO
O
O-
-
-C
C
CH
H
HI
I
IM
M
MI
I
IE
E
E
P
P
Pr
r
r
S
S
S
S
S
SA
A
AG
G
GU
U
UE
E
EM
M
M
Laboratoire de Biophysique
Faculté de Médecine de Sousse
Tunisie
D
D
Dr
r
r
K
K
K
C
C
CH
H
HA
A
AT
T
TT
T
TI
I
I
Laboratoire de Biophysique
Faculté de Médecine de Monastir
Tunisie

Physico-chimie Pr S SAGUEM Dr K CHATTI
2002 - 2 -
C
C
CH
H
HA
A
AP
P
PI
I
IT
T
TR
R
RE
E
E
I
I
I
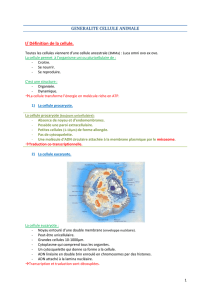
GÉNÉRALITÉS SUR LES SOLUTIONS
I
I
I.
.
.
DÉFINITION D’UNE SOLUTION
Une solution est un mélange homogène de deux ou plusieurs constituants. Le constituant
présent en plus grande quantité est appelé solvant. Les autres sont appelés solutés.
Habituellement le terme de solution est réservé aux mélanges pour lesquels le solvant est
liquide. On parle ainsi d‟une solution aqueuse lorsque le solvant est de l‟eau. Ceci est
particulièrement le cas des solutions dans tous les systèmes vivants.
Une solution est dite saturée en un constituant donné lorsqu‟elle contient la quantité maximale
de ce constituant que le solvant peut dissoudre.
II. CLASSIFICATION DES SOLUTIONS
La classification adoptée des solutions repose sur la taille des particules solutés. On distingue :
II.1. SOLUTIONS VRAIES OU MOLECULAIRES
II.1.1. SOLUTIONS CRISTALLOÏDALES OU MICROMOLECULAIRES
Ce sont des solutions pour lesquelles la taille des particules solutés est inférieure à un
nanomètre (1nm = 10-9m = 10 Angstrom (
o
A
)). Une solution cristalloïdale peut ou non être
ionisé selon la capacité du soluté de se dissocier dans la solution.
Exemples
- Solution ionisée :
o La solution aqueuse de NaCl est une solution ionisée et on a :
NaCl → Na+ + Cl-
o La solution aqueuse de CH3COOH est une solution ionisée, et on a :
CH3COOH → CH3COO- + H+

Physico-chimie Pr S SAGUEM Dr K CHATTI
2002 - 3 -
- solutions non ionisées
o solution de glucose
o solution d‟urée
II.1.2. SOLUTIONS COLLOÏDALES OU MACROMOLECULAIRES
Ce sont des solutions pour lesquelles la taille des particules solutés est supérieure à 10
o
A
et
inférieure à 103
o
A
.
Les macromolécules telles que les protéines et les acides nucléiques placées dans l‟eau forment
des solutions colloïdales.
II.2. PSEUDO-SOLUTIONS OU SOLUTIONS MICELLAIRES
Dans une solution micellaire, les particules solutés sont constituées par des agglomérats
moléculaires dont la taille dépasse plusieurs milliers d‟
o
A
. Chaque agglomérat est constitué par
l‟association de plusieurs molécules de façon à enfouir leurs groupements hydrophobes et
expose du coté de la phase aqueuse leurs parties polaires. Les membranes biologiques
constituent un exemple typique d‟une solution micellaire.
II.3. DISPERSIONS
Ce sont des solutions pour lesquelles la taille des particules solutés est suffisamment grande
pour être visible au microscope optique ou à l‟œil nu.
On distingue deux types de dispersions :
- Les suspensions : ce sont des solutions dans lesquelles les particules solutés sont sous
forme solide.
o Exp. Poudre fine dans l‟eau
- Les émulsions : ce sont des solutions dans lesquelles les particules solutés sont
dispersées sous forme liquide. (le solvant et le soluté liquide sont non miscibles)
o Exp. Eau-huile

Physico-chimie Pr S SAGUEM Dr K CHATTI
2002 - 4 -
III. LES PARAMETRES DE QUANTIFICATION DES SOLUTIONS
Dans une solution, il est important de déterminer la proportion des solutés par rapport à celle
du solvant. Pour cela, on dispose de deux types de grandeurs permettant d‟obtenir une telle
quantification : les concentrations et les titres.
III.1. LES CONCENTRATIONS
Les concentrations sont des grandeurs avec unités.
Selon la nature de l‟unité choisie, on distingue :
III.1.1. CONCENTRATION MOLAIRE OU MOLARITE CM
La molarité ou concentration molaire d‟une solution est le nombre de moles de chacun des
solutés contenus dans l‟unité de volume de la solution.
CM =
solution la de volumele soluté de moles de nombre le
Elle est exprimée habituellement en mole par litre (mol.L-1). Dans le système international
(MKS), la molarité est exprimée en mole par mètre cube (mol.m-3).
Si la solution contient plusieurs solutés, la molarité de la solution est donnée pour chacun des
solutés présents dans la solution.
Remarque
- Une solution est dite molaire pour un soluté donné lorsque CM = 1 mol.L-1
- Elle est dite décimolaire lorsque CM = 10-1 mol.L-1
- Elle est dite millimolaire lorsque CM = 10-3 mol.L-1
Exemples
1. Deux litres d‟une solution aqueuse contiennent une masse m=11,7g de NaCl
(la masse molaire de NaCl : M=58,5g)
- le nombre total de moles de NaCl est n =
M
m
=
5,58 7,11
= 0,2mole
- le volume total de la solution est V = 2L = 2x10-3 m3

Physico-chimie Pr S SAGUEM Dr K CHATTI
2002 - 5 -
- la molarité de la solution est :
CM =
V
n
=
22,0
= 0,1mol.L-1
CM =
V
n
=
10
x2 2,0 3
= 0,1x103 mol.m-3
2. Deux litres d‟une solution aqueuse contiennent une masse m1 = 11,7g de NaCl et
m2 = 11,1g de CaCl2 (masse molaire CaCl2 : M = 111g).
La molarité de la solution est :
CM1 =
V
n1
= 0,1mol.L-1 = 100mol.m-3
CM2 =
V
n2
= 0,05mol.L-1 = 50 mol.m-3
III.1.2. LA CONCENTRATION MOLALE OU MOLALITE Cm
La molalité ou concentration molale est le nombre de moles de chacun des solutés contenus
dans un kilogramme de solvant.
Cm =
solvantdu totalemasse soluté de moles de totalnombre
La molalité est exprimée dans le système (MKS) en mole par kilogramme (mol.kg-1).
Si la solution contient plusieurs solutés, la molalité de la solution est donnée pour chacun des
solutés présents dans la solution.
Remarques
- Dans le cas des solutions aqueuses suffisamment diluées, la molarité et la molalité sont
numériquement égales (CM = Cm). En effet dans ces conditions, la masse d’un litre
d’une solution est pratiquement égale à la masse d’un litre d’eau (1kg).
- On parle d’une solution molale, décimolale, … pour un soluté donné lorsque celle ci
contient une mole, 0,1mole, …de ce soluté par kilogramme de solvant.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
1
/
115
100%