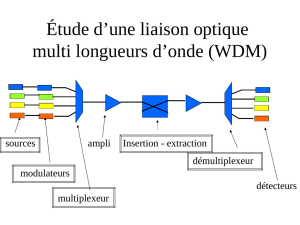
DEVOIR COMMUN N°2

Terminale S – Lycée Massignon
DEVOIR COMMUN N°2
Barème : ….. / 25
Durée : 2h
Les calculatrices sont autorisées.
Il sera tenu compte de la qualité de la rédaction et de la cohérence des chiffres significatifs.
Par oxydation ménagée, on peut obtenir :
- à partir d’un alcool primaire, un aldéhyde ou un acide carboxylique
- à partir d’un alcool secondaire, une cétone.
- à partir d’un alcool tertiaire, il n'y a pas d'oxydation.
Pour réaliser une oxydation ménagée, il faut faire réagir l'alcool avec un oxydant comme le CrO2 (les ions
permanganates ou dichromates oxydent de manière forte c'est-à-dire oxyde un alcool primaire en acide
carboxylique et non en aldéhyde). Il se produit alors une réaction d'oxydo-réduction.
Une réaction d'oxydo-réduction ou redox est une réaction chimique au cours de laquelle se produit un échange
d'électrons.
L'espèce chimique qui capte les électrons est appelée « oxydant » ; celle qui les cède, « réducteur ».
Un alcool inconnu noté A donne un produit d’oxydation noté B.
1. Analyse de la formule brute de B
Une molécule organique, notée B, a pour formule brute C4H8O. On sait qu’il ne s’agit pas d’une molécule
cyclique.
1.1. Quels sont les deux groupes caractéristiques connus qui sont compatibles avec la présence d’un
seul atome d’oxygène dans la molécule B ? A quelles familles de molécule cela correspond-t-il ?
1.2. Donner la formule semi-développée du butanol. En déduire sa formule brute.
1.3. Par comparaison de la formule brute de la molécule B, avec la formule brute du butanol,
confirmer la présence d’une liaison double au sein de la molécule B, soit entre deux atomes de
carbone, soit entre un atome de carbone et un atome d’oxygène.
2. Spectre IR de l’espèce chimique B
Le spectre IR de l’espèce chimique B en phase condensée est donné en Annexe 1 de chimie.
2.1. Quel renseignement ce spectre fournit-il sur l’espèce chimique B ? On pourra s’aider du tableau
donné en annexe 2.
2.2. Ecrire les formules topologiques des trois molécules envisageables, puis les nommer.
2.3. Rappeler la définition de l’isomérie. Quel type d’isomérie lie ces trois molécules ?
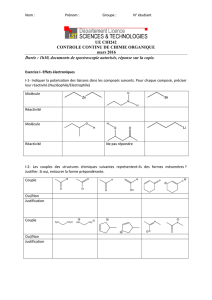
EXERCİCE N°1 : « Identifier une molécule» 40min ( 9 pts )

3. Spectre RMN et détermination du produit d’oxydation : B
La molécule B a été obtenue par oxydation d’un alcool secondaire A.
3.1. Conclure sur l’identité de la molécule B en vous aidant de l’annexe 3.
3.2. Etablir la formule développée de la molécule B. Y faire apparaître les protons considérés comme
équivalents pour un spectre RMN, justifier.
3.3. Parmi les spectres RMN donnés en annexe 4 (en vous aidant de l’annexe 5), indiquer celui qui
correspond à la molécule B. Justifier.
4. Bilan
4.1. Donner la formule de Cram (autour du C2) de l’alcool A.
4.2. Parmi les trois spectres IR (réalisés en phase condensée) donnés en annexe 6, indiquer celui
qui correspond à la molécule A. Bien justifier pourquoi vous éliminez les autres spectres.

La lumière est un « outil » précieux en chimie analytique. En effet, toute espèce chimique est susceptible
d’interagir avec des radiations lumineuses. Par exemple, une espèce colorée X absorbe certaines radiations
visibles.
Le principe de la spectrophotométrie repose sur la mesure de l’absorbance A de l’espèce X en solution dans un
solvant Y. Cette grandeur A est le résultat de la comparaison de deux intensités lumineuses : celle d’une radiation
monochromatique ayant traversé une cuve transparente contenant le solvant Y, et celle de la même radiation
émergeant de la même cuve contenant la solution de l’espèce X dans le solvant Y.
Schéma de principe d’un spectrophotomètre à prisme
1. Lumière et spectrophotométrie
1.1. Donner les valeurs limites des longueurs d’onde du spectre visible dans le vide et les couleurs
correspondantes.
1.2. Situer, du point de vue de leur longueur d’onde, les rayonnements ultraviolets et infrarouges par
rapport au spectre visible.
1.3. Le rôle du monochromateur dans un spectrophotomètre est de sélectionner une
radiation monochromatique particulière. Donner la définition d’une lumière
monochromatique.
2. Caractérisation des colorants d’un sirop de menthe
Sur l’étiquette d’une bouteille de sirop de menthe, on peut lire les indications
suivantes :
Afin de déterminer les colorants présents dans le sirop de menthe, le protocole expérimental suivant
est mis en place : une solution est préparée en diluant 10 fois la solution de menthe commercialisée. À l’aide
d’un spectrophotomètre, on obtient la courbe donnant l’absorbance A en fonction de la longueur d’onde
pour cette solution diluée de menthe. Le « blanc » du spectrophotomètre a été effectué avec une cuve
remplie d’eau distillée
EXERCİCE N°2 : « le sirop de menthe» 20min ( 3,5 pts )

Voici la courbe obtenue :
2.1. Que signifie « faire le blanc » du spectrophotomètre ?
En vous aidant de la courbe ci-dessus et des documents fournis en annexe, répondre aux questions
suivantes :
2.2. Déterminer la (ou les) longueur(s) d’onde correspondant à un maximum d’absorption.
2.3. Déterminer le nom des colorants présents dans le sirop de menthe. Cette conclusion est-elle en
accord avec les informations inscrites sur l’étiquette de la bouteille de sirop de menthe ?
Sirop de menthe dilué dix fois
0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
0,8
0,9
1,1
1,2
360 400 440 480 520 560 600 640 680 720
longueur d'onde
en nm
absorbance A
1,0

n° de corde
1
2
3
4
5
6
note
mi1
la1
ré2
sol2
si2
mi3
fréquence (Hz)
82,4
110,0
146,8
196,0
246,9
329,6
La guitare électrique est pourvue d'un corps le plus souvent plein, autorisant les luthiers à lui conférer
des formes originales. Elle produit des sons grâce à des micros captant et transformant les vibrations des
cordes en signal électrique. Ce signal peut ensuite être modifié électroniquement par divers accessoires comme
des pédales d'effets, puis amplifié.
La guitare électrique est composée de six cordes métalliques. L'accord traditionnel à vide est, de la note la
plus grave à la plus aiguë : mi1 la1 ré2 sol2 si2 mi3, le chiffre en indice indiquant le numéro de l'octave. Une
corde est dite « à vide » lorsqu'elle vibre sur toute sa longueur. Les fréquences des notes produites à vide par
les cordes pincées de la guitare sont données dans le tableau suivant :
Une guitare basse électrique fonctionne
sur le même principe avec des notes plus
graves.
La diversité des effets possibles avec une
guitare électrique en fait un instrument
polyvalent et riche musicalement. Parmi la
multitude d’effets accessibles grâce à une
pédale d'effets on peut citer l'effet « wha-
wha » popularisé par le célèbre guitariste
Jimi Hendrix.
Un système d'acquisition informatisé permet
l'enregistrement et la visualisation des
tensions électriques associées aux différentes
notes que peut produire une guitare électrique.
Les figures ci-contre présentent les signaux
enregistrés pour la même note de musique
jouée par une guitare électrique (figure ) et
par une guitare basse (figure ).
1. Guitare électrique et guitare basse
1.1. Les deux sons enregistrés sont-ils purs ou complexes ?
1.2. Quelle est la qualité physiologique commune des deux sons enregistrés ? Nommer la grandeur
physique associée à cette qualité physiologique.
1.3. Déterminer cette grandeur physique en précisant la méthode utilisée. En tenant compte de
l'imprécision de la mesure, en déduire la note de musique jouée par les deux instruments.
1.4. Quelle qualité physiologique permet de distinguer ces deux sons ?
EXERCİCE N°3 : « La pédale Wha wha » 30 min ( 6,25 pts )
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
1
/
22
100%