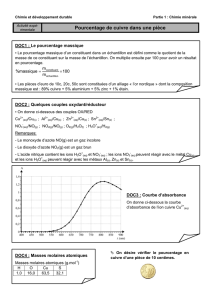
TP n°1 : ANALYSE D`UNE PIECE DE DIX CENTIMES D`EURO

Terminale S – Spécialité Chimie Page 1 © http://physiquark.free.fr
TP n°1 : ANALYSE D’UNE PIECE DE DIX CENTIMES D’EURO
1 - OBJECTIF
* Déterminer les différents métaux présents dans une pièce de monnaie (étude QUALITATIVE),
* Déterminer la teneur en cuivre dans la pièce (étude QUANTITATIVE), en utilisant une méthode de dosage par étalonnage.
2 - ATTAQUE DE LA PIECE DE MONNAIE
* Placer la pièce de monnaie de masse m = _____ g dans un erlenmeyer de 1 L et ajouter de l’acide nitrique concentré (travailler
sous hotte) .
* Ajouter de l’eau distillée une fois la pièce dissoute, et chauffer pendant quelques dizaines de minutes à l’aide d’une plaque
chauffante. Laisser refroidir. Neutraliser l’excès d’acide avec de la soude de manière à obtenir un pH voisin de 7. La solution
obtenue sera appelée solution (S),
* Transvaser le contenu dans une fiole jaugée d’un litre en récupérant les eaux de rinçage. Compléter avec de l’eau distillée au
trait de jauge. Soit (S) la solution obtenue.
✎
1 Ecrire l’équation de la transformation relative à la pièce de monnaie (on supposera qu’elle ne contient que du cuivre
métal par l’acide nitrique (H+aq, NO3-). On donne les couples rédox NO3-/NO Cu2+/Cu
✎
2 Pourquoi chauffe-t-on la solution pendant quelques minutes ?
3 - ANALYSE QUALITATIVE
On dispose des solutions suivantes : - chlorure de nickel (Ni2+,, 2Cl-)
- sulfate de cuivre (Cu2+,, SO42-)
- chlorure de cobalt (Co2+,, 2Cl-)
- chlorure ferrique (Fe3+,, 3Cl-)
Ces solutions seront préparées à raison de 0,5 mol.L-1 en soluté.
Dans 5 tubes à essais, introduire 1 mL environ de chacune des solutions précédentes et 1 mL de la solution (S).
Puis ajouter quelques gouttes de solution de soude à environ 1 mol.L-1.
✎
3 Noter vos observations. Quels ions peuvent-être présents dans la solution (S) ?
Ajouter alors environ 3 mL d'ammoniac concentré dans chacun des tubes.
✎
4 Noter vos observations. Peut-on affiner la réponse à la question précédente ?
4 - ANALYSE QUANTITATIVE Par spectrophotométrie visible
* On souhaite déterminer la teneur en cuivre dans la pièce de monnaie. Pour cela, on utilise une méthode spectrophotométrique.
* On réalisera un dosage par étalonnage à partir de solutions de sulfate de cuivre, en présence d’ammoniac.* On dispose au
bureau d’une solution (S0) de sulfate de cuivre à C0= 6.10-2 mol.L-1.
4.1 - Préliminaire
* Prélever 5 mL de sulfate de cuivre et ajouter 1 mL d’ammoniac à 1 mol.L-1 dans un tube à essai.
✎
5 Noter vos observations.
* On note la formation d’un complexe, composé soluble dans la solution (à ne pas confondre avec un précipité).
* La formation de ce complexe s’écrit : Cu2+ + 4 NH3 = Cu(NH3)42+
bleu ciel bleu roi ion tétraamminocuivre II
* Comparer le spectre de la solution (S0) et celle de la solution complexée par l’ammoniac.
✎
6 A votre avis, pourquoi fera-t-on l’étalonnage en présence d’ammoniac en excès ? Quelle sera alors le choix de la longueur
d’onde de travail ?
4.2 - Préparation des solutions étalons
* A partir de la solution (S0) au bureau, réaliser des solutions diluées (voir tableau ci-dessous) en milieu ammoniacal. On
réalisera 50,0 mL de solution (Si),de concentration Ci en ion cuivre (égale à la concentration en ion complexe coloré).
Solution (Si) S1S2S3S4S5S6
Ci (mol .L-1)
VNH3 (mL) 10 10 10 10 10 10
V0 (mL) 30 20 15 10 5 2
A
Avec : VNH3 : volume de solution d’ammoniac,
V0 : volume de solution (S0) à prélever.
Le restant en volume pour arriver à 50,0 mL sera de l’eau distillée.
N.B. Chaque groupe réalisera une solution diluée (groupe 1, solution S1 ; etc…)

Terminale S – Spécialité Chimie Page 2 © http://physiquark.free.fr
✎
7 Montrer que l’ammoniac est en excès par rapport aux ions cuivre dans chaque solution. En déduire que [Cu2=] =
[Cu(NH3)42+] dans les solutions diluées réalisées.
✎
8 Relever l’absorbance de votre solution pour la longueur d’onde choisie en
✎
6. Compléter le tableau ci-dessus. Tracer la
courbe d’étalonnage A=f(Ci) et modéliser la courbe. Quelle loi retrouve-t-on ?
4.3 - Détermination de la teneur en cuivre dans la pièce de monnaie
* Prélever 20 mL de solution (S) au bureau (voir 1). Verser ce prélèvement dans la fiole jaugée de 50,0 mL.
* Ajouter 10 mL d’ammoniac dans cette fiole jaugée, et compléter avec de l’eau distillée au trait de jauge. Soit (SD) la solution
obtenue.
* Mesurer l’absorbance AD de cette solution pour la longueur d’onde de travail choisie.
✎
9 Déterminer la concentration CD en ion complexe dans cette solution. Sachant que l’ammoniac a été introduit en excès,
déterminer la concentration en ion cuivre [Cu2+]D et la concentration [Cu2+] dans la solution (S).
✎
10 En déduire la quantité de matière en cuivre contenue dans la pièce de monnaie, ainsi que le pourcentage massique en
cuivre dans celle-ci. Comparer au tableau (voir données).
DONNEES
atome H C N O Cu
M (g.mol-1) 1,0 12,0 14,0 16,0 63,5
COMPOSITION DES PIECES DE MONNAIES (cf. Règlement (CE) du 3 mai 1998 n° 975/98)
1, 2 et 5 cents acier cuivré (acier recouvert de cuivre par électrolyse)
10, 20 et 50 cents alliage sans nickel dit or nordique (Cu89Al5Zn5Sn1)
1 euro Laiton de nickel (CuZn20Ni5)
Cu75Ni25 / Ni7 / Cu75Ni25
2 euros Cupronickel (Cu75Ni25)
Laiton de nickel (CuZn20Ni5) / Nickel (Ni12) / Laiton de nickel (CuZn20Ni5)
N.B. Les pourcentages donnés sont massiques.
1
/
2
100%