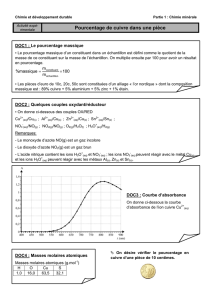
Détermination du pourcentage massique en cuivre

1
Détermination du pourcentage massique en cuivre
d’une pièce de monnaie de 10 centimes (TP).
Réponses aux questions
Questionnaire n°1 :
2-1-Justifier l’emploi de l’acide nitrique (H3O+ + NO3-) pour attaquer le cuivre plutôt
que l’acide chlorhydrique (H3O+ + Cl-).
Rappel :
« Règle du gamma » : étant donné deux couples d’oxydoréduction, une
réaction spontanée est possible(*) entre l’oxydant le plus fort (de potentiel
le plus élevé) et le réducteur le plus fort (de potentiel le plus faible).
L’anion nitrate est un oxydant plus fort que Cu2+, il peut donc oxyder le
métal cuivre. Par contre l’ion H3O+ ne peut oxyder Cu. Ainsi, l’acide
chlorhydrique n’oxyde pas le cuivre.
(*) c’est une condition nécessaire pour qu’une réaction se produise
spontanément mais pas forcément suffisante. Il faut de plus que les
conditions cinétiques (température, concentration) soient favorables.
2-2-Identifier l’espèce chimique formée dans la solution après la réaction.
La couleur bleue suggère la formation de l’ion cuivre (II) .
2-3-Ecrire les demi-équations électroniques de chaque couple et l’équation bilan.
oxydation du cuivre : (I)Cu Cu2++2 e-
Réduction de l’ion nitrate (procédons par étape)
Etape 1 : NO3- NO
Etape2 : équilibrage des O
NO3- NO + 2H2O

2
Etape 3 : équilibrage des H (H2O à droite et H+ à gauche)
4H+ + NO3- NO + 2H2O
Etape4 : équilibrage des charges (ajout d’électrons):
(II) 4H+ + NO3- + 3 e- NO + 2H2O
Bilan: il faut écrire que le nombre d’électrons cédés par le réducteur est
égal au nbre d’électrons captés par l’oxydant. Ainsi les e- n’apparaissent
pas dans le bilan
Additionnons: 3.(I)+2.(II) , il vient :
3Cu + 2 NO3- + 8H+ --> 3Cu2+ + 2NO + 4 H2O
2-4-Pourquoi faut-il rincer l’erlenmeyer et verser l’eau de rinçage dans la fiole ?
Il faut récupérer la totalité des ions cuivre( II) pour effectuer un dosage
précis de ces derniers pour ensuite évaluer la quantité d’atomes de cuivre et
la masse de cuivre dans la pièce de monnaie.
Questionnaire n° 2 :
3-2 1-Ecrire l’équation de la réaction de dissolution du soluté dans l’eau (celle-ci étant
totale).
CuSO4, 5H2O(couleur bleue) Cu2+aq + SO42-+ 5H2O
NB:La formule CuSO4 est celle du sulfate de cuivre anhydre qui est blanc.
3-2-2-Calculer la masse molaire moléculaire du sulfate de cuivre pentahydraté :
On donne MCu=63,5 g.mol-1 ; MO=16 g.mol-1 ,MS=32g.mol-1 ; MH=1,0g.mol-1.
M=63, 5+ 32 + 4.16 + 5.18=249,5 g.mol-1
3-2-3- En déduire la concentration Code la solution mère en mol.L-1.
1
0,30mol.L
249,5.0,1
7,5
M.Vo
mo
Vo
n
Co
Questionnaire n°3 :
Calculer les concentrations [Cu2+]aq dans chaque solution n°1, n°2, n°3 et n°4 ,sachant
que les volumes prélevés sont respectivement : 1,0mL ; 3,0mL ; 6,0mL ;9,0mL.
Présenter les résultats dans un tableau
Formule de la dilution :
Quantité prélevée dans la sol mère = quantité dans solution diluée
Co.Vm =cf.Vf
f
2
fV
Co.Vm
Cuc

3
Solution n°
1
2
3
4
Vm(mL)
1,0
3,0
6,0
9,0
[Cu2+](mol.L-1)
3,0.10-2
9,0.10-2
18.10-2
27.10-2
Questionnaire n°4 :
-La solution n°5 a une coloration quasi identique à la n°2
-Dans la solution Sp, [Cu2+] est donc proche de 9.10-2mol.L-1.
-Quelle est la quantité nP d’ions cuivre (II) dans la solution Sp ?.
np=[Cu2+].Vp = 9.10-2* 500.10-3=0,045mol.
-Sachant que l’acide nitrique transforme tous les atomes de cuivre de la pièce en ion
cuivre (II), déterminer la masse de cuivre mP contenue dans la pièce
mp = np*M(Cu)=0.045*63,5=2,9g
-Quel est le pourcentage massique en cuivre de la pièce. ? Comparer la valeur trouvée
avec la valeur théorique 92%.
97%100*
3,0
2,9
100*
3,0
mp
massique%
Ecart relatif avec la valeur théorique :
%5,5100.
929297
Cette méthode visuelle n’est pas d’une grande précision.
1
/
3
100%