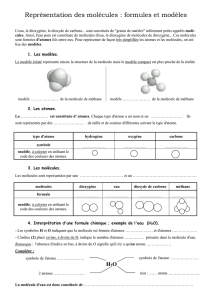
2) Les molécules

Chapitre 5 : Les transformations
chimiques
I. Modèle moléculaire
Coller activité expérimentale 1 « Modèle de l’atome et de la molécule »

1) Les atomes
L’atome est la plus petite particule de matière.
Comme il y a différents types d’atomes (
118
), on
les modélise par des petites boules de couleurs
différentes et de tailles différentes et on leur
donne un symbole.
Modèle
de
l’atome
Nom
Carbone
Hydrogène
Oxygène
Azote
Symbole
C
H
O
N

2) Les molécules
Dans la majorité des cas, les atomes ne restent
pas seuls, ils s’assemblent pour former des
molécules.
Les molécules sont donc constituées par des
assemblages d’atomes liés entre eux par des
liaisons chimiques.
On représente les molécules par une formule et un
modèle moléculaire.
Exemples : Les gaz dioxygène, dihydrogène,
dioxyde de carbone et méthane et l’eau liquide
sont constitués de molécules.

Que représentent les chiffres en indice ?
Ils indiquent le nombre d’atomes dans la molécule.
Exemple : Dans H2O, il y a 2 atomes d’hydrogène et 1 atome
d’oxygène.
Que représentent les lettres ?
Elles indiquent le nom des atomes dans la molécule.
Quand il n’y a pas de chiffre en indice, que cela signifie-t-il ?
Il est sous-entendu « 1 ».
Modèle
de la
molécule
Nom de la
molécule
Eau
Dioxygène
Diazote
Dioxyde
de
carbone
Méthane
Butane
Formule
chimique
de la
molécule
H2O
O2
N2
CO2
CH4
C4H10

Modèle
moléculaire
Formule
chimique
Nom
Ethanol
Eau oxygénée
Propane
Ethane
Acide
acétique
Modèle
moléculaire
Formule
chimique
Nom
Dioxyde d’azote
Ethanamide
dihydrogène
Ethylamine
Ether
méthylique
C2H6O H2O2 C3H8 C2H6 C2H4O2
NO2 C2H5NO H2 C2H7N C2H6O
Exercice d’application : Donne la formule chimique des molécules suivantes
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%