PACES - Année 2016-2017 - Tutorat Santé Lorraine

PACES - Année 2016-2017
UE 1 : Atomes, biomolécules, génome, bioénergétique et métabolisme
Concours blanc du 30/11/2016
: 2 heures
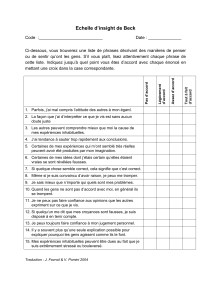
Vérifiez que votre fascicule comporte 21 pages et 80 QCM.
Pour chaque question, répondre vrai ou faux à chacun des items.
Pour chaque QCM, il peut y avoir 0, 1 ou plusieurs propositions vraies.
Les QCM marqués par (*) sont rédigés par les enseignants.
La calculette est interdite.
/verso. Vous pouvez utiliser la feuille de couleur située
épreuve.

© Tutorat Santé Lorraine 2016/2017 – Reproduction interdite même partielle.
2
Chimie : QCM Pr S. Boschi-Muller, Pr P. Leroy, Pr A. Mourer.
Q1- A propos des éléments et des atomes, dites si les affirmations suivantes sont vraies ou
fausses :
A. Les protons et les neutrons ont des masses à peu près identiques.
B. Un atome de calcium (Z=20, A=40) possède 40 nucléons.
C. La neutralité de l’atome s’explique par un nombre égal de neutrons et d’électrons.
D. Un atome de Zn (Z=30, A=65) possède 35 neutrons.
E. Les nombres A et Z caractérisent un nucléide.
Q2- A propos de la configuration électronique des éléments, dites si les affirmations suivantes sont
vraies ou fausses :
A. Le nombre maximal d’électrons dans le niveau M est de 18.
B. La règle de Hund indique l’ordre de remplissage des couches.
C. Les sous-couches f contiennent toutes 5 orbitales.
D. Le nombre quantique m permet de connaitre la géométrie de l’orbitale.
E. Le nombre quantique de spin « s » peut prendre 3 valeurs différentes : - ½ ; 0 ; +½.
Q3- A propos des éléments, dites si les affirmations suivantes sont vraies ou fausses :
A. L’atome Br (Z = 35) possède dans son état fondamental 18 électrons ayant comme nombre
quantique n = 3.
B. L’atome S (Z=16) possède dans son état fondamental 2 électrons non appariés sur sa couche
de valence.
C. L’atome Cr (Z = 24) possède dans son état fondamental des sous-couches 4s et 3d à moitié
remplies.
D. Les halogènes peuvent donner des anions divalents.
E. Les chalcogènes ont une configuration électronique externe de type ns²np5 dans leur état
fondamental.
Q4- A propos des éléments, dites si les affirmations suivantes sont vraies ou fausses :
A. La configuration ns²np6 est la configuration d’un gaz rare.
B. La masse atomique d’un atome est la somme des masses ses constituants.
C. La formation de l’ion Na+ à partir de l’élément Na (Z = 11) correspond à l’arrachement d’un
électron de la couche 2p6.
D. Un atome est paramagnétique s’il possède des électrons célibataires.
E. Un atome de carbone dans son état fondamental contient sur sa couche externe 2 orbitales
complètement pleines.
Q5- A propos de la configuration électronique des ions, dites si les affirmations suivantes sont
vraies ou fausses :
A. L’ion Cl- (Cl, Z = 17) a dans son état fondamental la configuration 1s² 2s² 2p6 3s² 3p5.
B. L’ion Na+ (Na, Z = 11) possède 11 électrons dans son état fondamental.
C. L’ion Mg+ (Mg, Z=12) a une configuration électronique identique à celle de l’atome Na (Z=11).
D. L’ion Ca2+ (Ca, Z = 20) a 1 couche électronique complète dans son état fondamental.
E. L’ion Fe2+ (Fe, Z = 26) possède dans son état fondamental 2 électrons appariés sur son
orbitale 4s.
Q6- A propos des éléments, dites si les affirmations suivantes sont vraies ou fausses :
A. L’affinité électrique du fluor est supérieure à celle de l’oxygène.
B. Le potentiel d’ionisation du potassium est inférieur à celui du soufre.
C. Les éléments de transition ont une sous-couche d en cours de remplissage.

© Tutorat Santé Lorraine 2016/2017 – Reproduction interdite même partielle.
3
D. Les halogènes ont une électronégativité supérieure à 2 selon Pauling.
E. Les alcalino-terreux sont très électronégatifs et donnent facilement des anions.
Q7- A propos de la géométrie des molécules, dites si les affirmations suivantes sont vraies ou
fausses :
A. La molécule PCl5 appartient selon la théorie VSEPR au type AX5.
B. La molécule SO2 a une géométrie coudée.
C. La molécule NH3 a une géométrie tétraédrique.
D. Dans la molécule de monoxyde de carbone (CO), l’atome de carbone est hybridé sp.
E. La molécule CH4 a une géométrie plane.
Q8- A propos des molécules, dites si les affirmations suivantes sont vraies ou fausses :
A. Les cations de petites tailles ont une énergie de solvatation plus faible que celles des anions.
B. Une liaison dative est la mise en commun des électrons des atomes.
C. La molécule de dihydrogène est peu réactive.
D. Une molécule de géométrie linéaire ne possède pas de paires électroniques non liantes.
E. Dans la molécule d’éthylène, les moments dipolaires des liaisons s’annulent donc la molécule
est non polaire.
Q9- Dites si les affirmations suivantes sont vraies ou fausses :
A. Dans la molécule Fe(H2O)62+, les ligands H2O occupent des orbitales hybrides sp3d.
B. Dans la molécule Fe(H2O)62+, le fer est sous la forme de cation Fe2+.
C. Dans la molécule Co(NH3)5+, l’hybridation des orbitales atomiques du cobalt est de type sp3d2.
D. Les forces de London correspondent aux forces dipôles induits/dipôles induits.
E. Les alcanes ne sont pas miscibles à l’eau.
Q10- A propos de la thermodynamique, dites si les affirmations suivantes sont vraies ou fausses :
A. La bombe calorimétrique est un exemple de système fermé.
B. L’enthalpie est une fonction d’état.
C. Le troisième principe de la thermodynamique stipule que l’entropie d’un corps cristallin est
nulle à 0°C.
D. Un système fermé échange de la matière avec l’extérieur.
E. Le travail est un transfert d’énergie susceptible de modifier la hauteur d’un poids placé dans le
milieu extérieur.
Q11- 3-/I2. Dites si les affirmations
suivantes sont vraies ou fausses :
A. Le nombre d’oxydation de l’ion iodate est égal à –I.
B. Le nombre d’oxydation de l’atome d’iode au sein de l’ion iodate est égal à +II.
C. Il y a échange de 12 H3O+ et de 10 électrons dans la demi-réaction d’oxydo-réduction du
couple IO3-/I2.
D. Il y a échange de 5 H3O+ et de 2 électrons dans la demi-réaction d’oxydo-réduction du couple
IO3-/I2.
E. Il y a échange de 8 H3O+ et de 6 électrons dans la demi-réaction d’oxydo-réduction du couple
IO3-/I2.
Q12- On dispose des 2 couples oxydant-réducteur suivants avec leurs potentiels standards :
Fe3+/Fe2+ (E° = 0,771 V) et Cu2+/Cu (E° = 0,337 V). Dites si les affirmations suivantes sont vraies
ou fausses :
A. Fe3+ oxyde Cu2+.
B. Fe3+ réduit Cu2+.

© Tutorat Santé Lorraine 2016/2017 – Reproduction interdite même partielle.
4
C. Fe3+ oxyde Cu.
D. Cu2+ oxyde Fe3+
E. La réaction qui part de Fe2+ et donne Fe3+ est une réduction.
Q13- 3H6O3),
- 1363 kJ.mol-1, dites si les affirmations sont vraies ou fausses :
A. Elle produit 3 moles de dioxyde de carbone.
B. Elle produit 3 moles d'eau.
C. Elle nécessite l'apport de 6 moles de dioxygène.
D. La réaction est endothermique.
E. La calorie est l’unité de mesure de la chaleur dans le système international (SI).
Q14- 3PO4 de concentration 0,2 mol.L-1, dites si les
affirmations suivantes sont vraies ou fausses :
Données :
pKa (H3PO4/H2PO4- )= 2,1
pKa (HPO4 2-/ PO43- ) = 12,4
pKa (H2PO4 - /HPO4 2- ) = 7,2
log(2) = 0,3
A. L’acide phosphorique H3PO4 est un polyacide.
B. L’acide phosphorique H3PO4 est un ampholyte.
C. Le pH de cette solution est 0,7.
D. Le pH de cette solution est 1,4.
E. Le pKb du couple H3PO4/H2PO4-est égal à 4,9
Q15- contient un groupement acide carboxylique faible COOH (pKa = 3,5) dans sa
structure. On dissout
sont vraies ou fausses :
A. L’espèce prédominante à pH = 7,5 est moléculaire.
B. L’espèce prédominante à pH = 1,2 est ionisée.
C. A pH = 4,5, il y a 10 fois plus de forme basique que de forme acide.
D. La valeur de pH dans une solution aqueuse d’aspirine à une concentration de 1 M est
supérieure à 2.
E. La constante d’acidité de l’aspirine est égale à 103,5.
Q16- On place une lame de zinc dans 100 mL de sulfate de cuivre en solution ayant une
concentration de 0,01 mol.L-1-
Zn + Cu2+ Zn2+ + Cu. Le cuivre étant le réactif limitant, dites si les affirmations suivantes sont
vraies ou fausses :
Données : M(Zn) = 65,4 g.mol-1 ; M(Cu) = 63,5 g.mol-1
A. La masse de zinc réduite est de 65,4 mg.
B. La masse de zinc oxydée est de 65,4 mg.
C. La masse de zinc réduite est de 65,4 g.
D. La masse de zinc oxydée est de 65,4 g.
E. Le nombre d’oxydation de l’ion cuivrique est égal à +II.
Q17-
vraies ou fausses :
A. La valeur de K supérieure à 10-4 indique qu’à l’équilibre les produits de la réaction
prédominent.
B. Une valeur de K supérieure à 104 correspond à une valeur de l’énergie de Gibbs ΔG de cette
réaction négative.

© Tutorat Santé Lorraine 2016/2017 – Reproduction interdite même partielle.
5
C. Une réaction en faveur de la conservation des réactifs suppose une constante d’équilibre
inférieure à 10-3.
D. Une valeur de K > 1 correspond à une variation d’enthalpie libre standard positive et à une
réaction déplacée vers la formation des produits.
E. Une réaction totale est une réaction en faveur de la formation des produits pour laquelle
K>103.
Q18- :
A. L’enthalpie de sublimation est égale à la somme des enthalpies de fusion et de vaporisation.
B. Les enthalpies de vaporisation et de liquéfaction sont égales et de signe opposé.
C. L’enthalpie de première ionisation est supérieure à l’enthalpie de deuxième ionisation.
D. L’enthalpie d’une réaction de combustion est positive.
E. L’enthalpie de formation d’une liaison est égale et de signe opposé à son énergie de
dissociation.
Q19- On dissout du formiate de sodium HCOONa
0,2 mol.L-1. Le pH de la solution est égal à :
Donnée : pKa(HCOOH/HCOO-) = 3.70 et log(2) = 0,3
A. 5,5
B. 6,5
C. 7,5
D. 8,5
E. 9,5
Q20- Dites si les affirmations suivantes sont vraies ou fausses : (*)
A. Dans une liaison polarisée les électrons sont situés préférentiellement du côté de l’atome le
moins électronégatif.
B. Les halogènes sont inductifs donneurs d’électrons.
C. Les effets inductifs donneurs peuvent stabiliser un carbocation.
D. Un groupement –OCH3peut stabiliser un carbocation.
E. Un groupement mésomère donneur est toujours inductif donneur.
Q21- Les effets électroniques : dites si les affirmations suivantes sont vraies ou fausses :(*)
A. La molécule A est stabilisée par mésomérie.
B. B est plus stable que A.
C. C et D sont identiques.
D. Le carbocation E est stabilisé par un effet inductif.
E. Un effet inductif est plus fort qu’un effet mésomère.
AB
C D
1
2
3
4
5
61
2
3
4
5
6
1,3,5-cyclohexatriène 2,4,6-cyclohexatriène
E
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
1
/
21
100%