J0 - réseau Sentinelles

BIVIR Pandémie
Présentation et schéma
Bivir-PANDEMIE 1
Présentation et schéma

ESSAI BIVIR
Essai randomisé
en double insu
comparant l’association oseltamivir et zanamivir à
Bivir-PANDEMIE 2
l’oseltamivir et placebo
dans le traitement curatif de la grippe de type A
virologiquement confirmé en médecine ambulatoire.

LISTE DES PARTICIPANTS
Investigateur Coordonnateur
Catherine LEPORT, université Diderot, Paris 7
Comité de pilotage
Laurent Andreoletti Laboratoire de Virologie, Hôpital R. Debré, EA-3798 Faculté de Médecine, Reims
Thierry Blanchon, Réseau Sentinelles, Inserm UPMC UMR S 707
Fabrice Carrat, Hôpital Saint-Antoine, APHP, Inserm UPMC UMR S 707
Xavier Duval, CIC Hôpital Bichat, APHP, Paris
Bruno Lina, CBPE, CNR du virus influenzae (Région Sud, Lyon)
Sandrine Loubière, Inserm unité 379, Institut Paoli-Calmettes, Marseille
France Mentré, INSERM et Université Paris
7
UMR
738
, UF de Biostatistiques, Hôpital Bichat, APHP
Bivir-PANDEMIE 3
France Mentré, INSERM et Université Paris
7
UMR
738
, UF de Biostatistiques, Hôpital Bichat, APHP
Anne Mosnier, Réseau des Grog, Paris
Annick Tibi, AGEPS, Pharmacie Centrale des Hôpitaux, Assistance Publique, Hôpitaux de Paris
Sylvie van der Werf, Institut Pasteur, CNR du virus influenzae (Région Nord, Paris)
Florence Tubach, URC Paris Nord, Groupe Hospitalier Bichat-Claude Bernard
Aurélie Guimfack, Délégation de la Recherche Clinique, AP-HP
Coordinateur d’essais cliniques URC
Isabelle Hoffmann, URC Paris Nord, Groupe Hospitalier Bichat-Claude Bernard
Assistante chef de projet DRC
Christine Lanau, Délégation de la Recherche Clinique, AP-HP
Promoteur
DIRC Ile de France

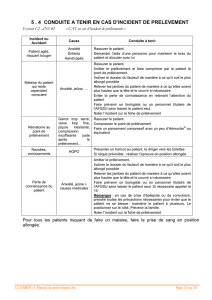
ASPECTS REGLEMENTAIRES
Avis favorable du CPP le 18/07/08
Amendement le 07/09/09
Bivir-PANDEMIE 4
Amendement le 07/09/09
Autorisation l’AFSSAPS le 11/08/08
Amendement le 17/09/09

SOMMAIRE
Justification de l’essai
Méthodologie
Objectif principal
Bivir-PANDEMIE 5
Objectif principal
Objectifs secondaires
Schéma de l’étude
Définitions:évènements indésirables,EIG
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
1
/
40
100%