Animal transgénique

Pourquoi les cellules de mammifères ?
- Les cellules de mammifères permettent :
o La production de protéines complexes
Ac et facteurs de coagulation
o L’amélioration de l’expression des protéines par rapport aux autres systèmes
Gluycosylation : la N-glycosylation est possbile dans les lignées cellulaires de mammifères
Repliement des protéines
I. Production dans les cellules
A) Les lignées de cellules de mammifères utilisées
Lignée
Nature
Mode de croissance
BHK 21 (clone 13)
Cellules de rein de hamster
Syrien
Adhérentes
NSO
Myélome murin (de souris)
En suspension
CHO (les plus utilisées pour
la production de
glycoprotéines
thérapeutiques
Cellules d’ovaires de
hamster chinois
Adhérentes (morphologie de
type épithéliale)
HEK 293 (beaucoup plus
utilisées actuellement car ne
nécessitent plus de sérum)
Cellules de rein d’embryon
humain
Adhérente (certaines en
suspension)
B) Autres types cellulaires
- Cellules souches somatiques
- Cellules souches embryonnaires
- Culture de cellules primaires
C) Les vecteurs utilisés dans les cellules de mammifères
- Plasmides
- Adénovirus
- Rétrovirus :
o Virus de la leucémie de Moloney
o Lentivirus
- Baculovirus

1) Les plasmides
- Les plus courants :
o pcDNA
o Pires
(Cf. Chapitre 5 et TD6)
2) Les adénovirus
Virus non enveloppé à ADN db, linéaire de 30-38Kb
- Entouré d’une capside formé de 252 capsomères
- Hôtes naturels de l’homme pour certains
- Utilisation des sérotypes 2 et 5 (non tumorigènes, non oncogènes)
- Large tropisme
- Génome adénoviral code 11 protéines différentes
- Gènes précoces E (early)
- Gènes tardifs L (late)
- Ces vecteurs adénoviraux permettent d’insérer jusqu’à 8Kb d’ADN étranger
- L’adénovirus recombiné est utilisé est utilisé pour transfecter des cellules (HEK 293 modifiées pour
produire les protéines E1 et éventuellement E3)
- Dans ces cellules, l’ADN viral est répliqué et les protéines virales produites
- Les virions formés sont récoltés et serviront à transduire les cellules dans lesquelles on souhaite exprimer
le transgène
- L’adénovirus recombinant peut infecter de nombreux types cellulaires (en prolifération mais aussi
quiescents)
- Après transduction virale de la cellules hôte, présence de nombreuses copies du virus
- Ceci permet une forte expression transitoire du transgène
o Ses gènes ne sont pas exprimés (absence des protéines transactivatrices E1 (et E3 parfois)
o Le transgène est exprimé à partir d’un pCMV (promoteur CMV)
Exemple d’un vecteur adénoviral : Système Clontech : Adeno X
3) Les rétrovirus
- Famille de virus enveloppés à ARN trouvée chez tous les vertébrés
- S’intègrent dans l’ADN de la cellule hôte
Outils puissants pour infecter tout type de cellules de mammifères en division ou en quiescence
a) Les différents types de rétrovirus
- γ-rétrovirus : virus simple
- Lentivirus
- Spumavirus
b) Réplication des rétrovirus sauvages
- Libération d’ARN
- Transformation en ARN double brin par une transcriptase inverse

- Séquence LTR + séquence PSY → intégration dans le génome
- Expression du génome viral
- Transport, fabrication des protéines virales
L’ensemble s’assemble pour reformer des nucléocapsides → reformation du rétrovirus à l’extérieur de la cellule
c) Vecteurs dérivés des rétrovirus
Rétrovirus MoMLV
Virus de la leucémie murine de Moloney
Remplacement des gènes gag pol env par le transgène
d) Encapsidation du gène thérapeutique dans la capside et l’enveloppe virale
Transfert du gène d’intérêt dans une lignée cellulaire d’encapsidation
Transcription, transport puis maturation avant traduction
e) Transduction des cellules cibles et expression du gène thérapeutique
Rétrovirus recombinant → ADN véhiculé dans la cellule → transcription inverse → intégration dans le noyau
Transcription du gène d’intérêt
Les vecteurs rétroviraux
- Si le vecteur rétroviral dérive de MoMLV : transfection des cellules en mitose uniquement
- Pour la transfection de cellules quiescentes :
o Utilisation de vecteurs dérivés des lentivirus qui présentent des séquences permettant le
transport du génome viral à travers la membrane nucléaire (cPPT = central polypurine tract)
Les vecteurs rétroviraux permettent :
- La transduction de nombreux types cellulaires (cultures primaires, cellules souches, etc…)
- L’obtention d’une expression stable par intégration du transgène dans le génome de la cellule hôte – taux
d’expression dépend du lieu d’insertion
D) Régulation de l’expression dans les cellules de mammifères
1) Le système TetOn / TetOff (Clontech)
a) Le système TetOff
- Promoteur modifié (séquence TRE : tetracycline responsive element) de manière à pouvoir contrôler
l’expression, par une protéine (tTa-Advanced) transactivatrice
tTA = protéine transactivatrice formée du domaine de liaison à l’ADN de tetR associé à 3 unités du
domaine transactivateur de la protéine VP16 (protéine d’activation) de HSV. Se lie en absence de
tétracycline.
Dans TetOff : transcription du transgène en absence de tétracycline
b) Le système TetOn
La différence réside dans la nécessité d’avoir de la tétracycline pour activer la transcription du transgène.
rtTA = Protéine transactivatrice formée du domaine de liaison à l’ADN de tetR associé à 3 unités du domaine
transactivateur de la protéine VP16 de HSV. Se lie en présence de tétracycline (ou doxycycline).

Remarque : Dans ce système inductible, nécessité d’utiliser des cellules exprimant la protéine transactivatrice HEK
(ou autres cellules modifiées).
E) Protéines d’intérêt thérapeutique produites dans des cellules de mammifères
Production de l’activateur tissulaire du plasminogène = tPA = protéase à sérine
Dissolution des caillots sanguins par action sur la fibrine.
- tPA est un agent fibrinolytique puissant administré lors d’infarctus du myocarde
- Un déficit en tPA mène à un risque accru de thromboses
Mode d’action
(Schéma poly)
L’altéplase
- L’altéplase, obtenu par génie génétique, est une glycoprotéine de 527 acides aminés, 35 cystéines, 14
ponts disulfures et de nombreux sites de glycosylation
- Identique à l’activateur tissulaire du plasminogène ou tPA
- Premier médicament produit commercialement à partir de culture de cellules mammifères par
Genentech
o Réservé à l’usage hospitalier, administré par voie IV (3 dosages différents : 110, 20 et 50mg)
o Coût : 2200$ / 100mg ; La production dans les CHO coûte environ 10 000$ / g
Actuellement, 60/70% des protéines recombinantes pharmaceutiques sont produites dans des cellules de
mammifères.
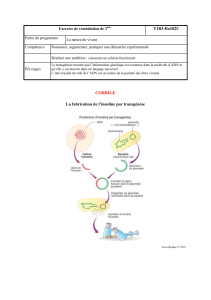
I. II. Production de protéines recombinantes à partir d’animaux
transgéniques
Animal transgénique : animal dont la patrimoine génétique a été modifié par l’Homme
A) Principe général
Gène à expression tissu spécifique (β caséine) + Gène étranger → Gène hybride (Promoteur pour une expression
tissu-spécifique + Région codante)
Production de protéines recombinantes grâce à diverses techniques de transgénèse
B) Les différentes techniques de transgénèse
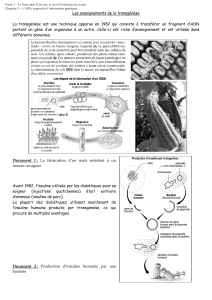
1) Micro-injection d’ADN dans le pronucléus
But : intégrer ce nouvel ADN dans le chromosome
- Traitement hormonal de la souris femelle
- Accouplement des souris
- Prélèvement et sélection des ovules fécondés (pronucléus mâle et pronucléus femelle distincts)
- Micro-injection directe de la solution d’ADN dans le pronucléus mâle
- Ré-implantation de l’embryon micro-injecté dans l’oviducte de la souris
- Génotypage de la descendance (présence du transgène révélée par les fragements obtenus par PCR)

Les souris 1 et 2 sont qualifiées d’animaux fondateurs (F0). Le pourcentage de réussite varie de 0 à 20%.
La lignée germinale est stable
- Extraction de la protéine recombinante (lait généralement)
2) Technique ICSI
ICSI (intracytoplasmic sperm injection) largement utilisée en clinique comme méthode de reproduction
médicalement assistée dans le cas de stérilité humaine dans les laboratoires pour des recherches sur la
reproduction.
Principal avantage de l’ICSI : possibilité d’obtenir de longs fragments d’ADN avec une efficacité relativement
bonne en comparaison avec l’injection dans les pronucléi.
Les différentes étapes de la méthode ICSI
- Première étape : prélèvement des spermatozoïdes → une fois prélevés, ils seront mis en contact avec
l’ADN étranger dans un milieu de culture
- Deuxième étape : recueil des ovocytes
o Injection d’hCG pour permettre l’ovulation et ainsi avoir un ovocyte mature
o Prélèvement de l’ovocyte au stade métaphase II (présence d’un globule polaire)
- Troisième étape : l’ICSI
o Un spermatozoïde sera directement injecté dans le cytoplasme de l’ovocyte à l’aide de popettes
en verre très fines
o Un microscope équipé d’une excellent optique et une paire de micromanipulateurs seront
nécessaires
Ensuite, le processus de la fécondation se poursuit comme dans une fécondation naturelle (in vitro).
Si la fécondation (la fusion des noyaux des deux gamètes) a eu lieu normalement, on peut observer, environ 18
heures après l’injection, la présence des deux pronucléi au centre du cytoplasme et la présence du deuxième
globule polaire dans l’espace périvitellin.
Induction des embryons chez les femelles receveuses → la descendance porte dans son génome le gène étranger
(taux de réussite de 20%).
3) L’infection virale
(Schéma)
4) Transgénèse via le clonage
(Schéma)
Le clonage par transfert de noyau a donné naissance à la brebis Dolly.
Principe : cellules génétiquement modifiées puis sélectionnées comme donneuses de noyau pour réaliser des
clonages
Protocole en 5 étapes
- Isolement des cellules somatiques ou pluripotentes, mises en culture
- Des cellules sont transfectées avec un vecteur permettant l’addition ou le remplacement de gène
- Sélection des clones porteurs du gène étranger par une double sélection positive et négative
- Introduction du noyau ou de la cellule sélectionnée dans le cytoplasme d’un ovocyte énucléé
Formation d’un embryon complet
- Introduction de l’embryon dans une mère adoptive
 6
6
1
/
6
100%