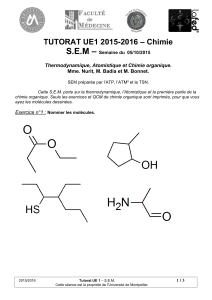
Introduction à la Biochimie

Introduction à la Biochimie
I. Généralités sur les Molécules en biochimie
Organisme Humain : H2O = plus Grande Masse
60 – 65 % → Adulte
78 % → Nouveau-Né
70 % → Nourrisson
Biochimie : Centrée sur le Carbone
Permet de constituer 100'000 molécules chez l’Homme
50% Poids sec du corps Humain
4 Liaisons : Simples (saturées) CH4
Doubles (insaturées) O = C = O
Triples (insaturées) H – C = C – H
Les Molécules sont de 2 types :
Simples (assez inertes) : Carbone + Hydrogène (linéaire, ramifié ou cyclique)
Complexes (réactives ++) : H remplacé par N, P, O, S [plus électro-réactifs]
Augmentation polarité, solubilité et réactivité des molécules
Molécules simples (monomère) Complexes (polymères / macromolécules)
Glucose Glycogène
4 Familles : Lipides (Acides Gras, Triglycérides, Cholestérol, …)
Glucides (oses simples [glucose], polysaccharoses [glycogène])
Acides Aminés, Peptides, Protéines
Nucléosides, Nucléotides
Groupement
Phosphate
Façon d’activer/désactiver
une fct° protéique
Ajout = Kinase
Suppr = Phosphatase
Aldéhyde
Cétone
Sulfhydryl

II. Liaisons entre Atomes
Fortes énergie = > 100 kJ.mol-1
Faible énergie = < 100kJ.mol-1
A. Liaisons Covalentes
Moyenne : 400 kJ.mol-1 (fortes)
Partage : d’un ou plusieurs e- (ex C – C)
Règle de l’octet : stabilisation de sa couche ext d’e-
1 à 3 paires d’e- entre 2 atomes (1 à 3 liaisons) [de + en + solide]
Pas de 4 liaisons entre 2 atomes en bio Hum
Molécules Polaires / Apolaires :
Si Liaison avec Atomes + électronégatif (O & N) : dipôle (δ+ et δ-)
Molécule polaire
Grande réactivité chimique
Si pas de déséquilibre (surtout avec C & H) alors Apolaire (peu réactives)
Polaire : Hydrosoluble : pas transporteur dans le sang (Glucose)
Apolaire : Non Hydrosoluble : transporteur sanguin (lipides se lient avec apoprotéines)
Ionisation : tellement de déséquilibre Rupture électrolytique
Na – Cl Na+ (cation) & Cl- (cation)
Radicaux Libres : Rupture de liaison homolytique
O = O 2 O°
Electrons non Appariés = très instable !
Altération d’autres molécules : Acides Nucléiques, Lipides, …
Mutations ADN Peroxydation lipidique
TOXIQUES
Cancérisation Mort CellR, Vieillissement
Dérivés Réactifs de l’Oxygène (DRO) :
Radical hydroxyde HO°
Radical Alkoxyle RO°
δ+ δ-
C = O
Stress Oxydant
(si plus d’oxydants que d’antioxydants)

Lutte Enzymatique :
Superoxyde dismutique, catalase, péroxyrédoxine, lactoperoxydase,
glutathion peroxydase
Antioxydant :
Glutathion, Vit E & C (intracell ++)
Acide urique (extracell)
B. Non Covalente
Pas de mise en commun d’e- donc :
Moins forte que covalente (10x moins)
Reformation facile
Liaison Ionique (en solution) :
Entre un atome + et atome –
Liaison hétéro-polaire / « pont de sel »
4 kJ.mol-1 / si même atomes mais état solide (200kJ.mol-1)
Liaison Hydrogène : 40 kJ.mol-1
Quand H lié avec atome fortement électronégatif (O ou N)
H : petite charge positive
Peut interagir avec atome avec petite charge négative
Et aussi entre et avec molécules d’eau
Liaisons de Van Der Waals : 10 kJ.mol-1 (en moy)
Quand déséquilibre = formation temp de dipôle élec
2 molécules dipolaires = rapprochement / même moment
Orientation appropriée
Faible attraction de Van der Waals
Liaison H : type particulier de liaison de Van der Waals incluant H
Interaction hydrophobe :
Hydrophobes : éviter le contact avec l’eau

III. Acides Aminés
A. Introduction
Cadre des protéines : grec protos = premier, + important, car :
Cellule : > 50% des molécules (poids sec)
Structure liée au code génétique
Molécule induisant formation d’autres molécules (enzymes)
Acides Aminés (AA) : sous-unités monomériques des peptides / protéines
Liaison peptidique
Protéine > peptide > AA
Acide Aminé : Nom général dû à leur structure (Fct° COOH / NH2)
Forte Conservation entre Eucaryote et Procaryote
Les Bactéries peuvent produire des protéines humaines ( « Recombinantes » )
ADNC Humain de l’Insuline
Diabète de type 1
Hormone de Croissance
Retard de Croissance Osseux
2 Grandes Familles : Appartenance non exclusive
1) A.A. à Rôle Protéinogène
Synthèse peptidique/protéique (250-300g par jour chez l’H)
20 A.A. historiques
Retrouvés identiques ou modifiés (modif post traduc) dans structure peptidique/protéique
+ 2 AA rajoutés :
Sélénocystéine : homme/bactérie
Sélénium prend la place du soufre dans la cystéine (mais formée à partir sérine)
Sert product° Glutathion peroxydase (lutte DRO)
Thioréduxine réductase / désiodase (métabolisme hormone thyroïdienne)
Pyrolysine = archéobactérie méthanogène
Méthyl-transférase
2) A.A. à Rôle Non Protéinogène
300 AA
Précurseur de molécules complexes : Glycine → Hème → Hémoglobine
Réserve d’énergie : Créatine – Phosphate (vertébrés)
Arginine – Phosphate (invertébrés)
Production
Bactérienne
liaison type Phospho – Amidine

Précurseur Hormonal :
Dérivé iodé de tyrosine / hormone thyroïdienne
Mono-Iodotyrosine (MIT) / Di-Iodotyrosine (DIT)
T3 (tri-iodotyrosine : MIT + DIT) / T4 (tétra-iodotyrosine : DIT + DIT)
Coagulation Sanguine : γ Carboxy-Glutamate (liaison Ca2+)
Neurotransmission (excitateur / inhibiteur)
Glutamate (+)
Glycine (-)
Acide γ aminobutyrique (GABA) : dérivé Glutamate (-)
Métabolisme : A.A. Glucoformateur (néoglucogenèse)
Métabolisme, transport et élimination de l’azote
Production du monoxyde d’azote (NO)
B. Structure / Propriétés Physico-Chimiques
1) Structure
Fonction Acide Carboxylique
Fonction amine primaire (basique)
Sauf Proline : amine secondaire (α imino-acide / acide α iminé)
Groupe R : Radical Latéral
Responsable des propriétés chimiques et physiques
Carbone α : porteur COOH, NH2, H et R (donc n°2)
Autres carbones β (3), γ (4), δ (5), ε (6)
2) Propriétés Physiques
Présence d’un Carbone asymétrique
17 AA = 1 C*
2 AA = 2 C* (Thréonine / Isoleucine)
Glycine = 0 C*
Convention de Fischer / Modèle Glycéraldéhyde
L : laevus (gauche) / D : Dextra (droite)
α
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%