sujet - profdephysique

!"#$%&'()*%%+&'##% ""$()* &*%&%+(,#$%&'()*%-./00
,+& &% %&'% 1%*2 "$ )*%+ 3%'4 $%+ % 3(+5653(+7 1(+& &%+ 1% 1 . 70 !7
*%"%'#%1*,'(8%%%&%-9%+$(:%+1% !"+,&&' #%++*'$%
+#! 9,*&$%1(+",+(4;%+&+,*+*3(1%1 ('",*++#9
#&*1(%' ,!!% +<+&=!% >$#$%&',? ,+(1#'# ,!!% ",&*%$7 1 + *
'#;#'%4%$&%''%+&'%+*"",+#: $($#%9
DONNÉES : charge élémentaire : e = 1,6×10-19 C ;
masse de l’électron : me = 9,1×10-31 kg ;
intensité de la pesanteur : g = 9,81 N.kg-1.
9 % !"#$%&'()*%%+&5($* !"+ $ ('%,*3%&,'(%$@
A9 #1*('%1*&' #1%+$(:%+1% !"$ 1('%4,%&$%+%+1*3%&%*' !"
#$%&'()*%
⃗
9
B9 1!%C' )*% $ 3 $%*' 1* !" #$%&'()*% %&'% $%+ 1%*2 "$ )*%+ %+&
1,#%%&,*&",(&" '$ '%$ 4,
=
1
D,#:$(:%$%+%E%&+1%F,'1G9
% !"%+&5($*(;,'!%@
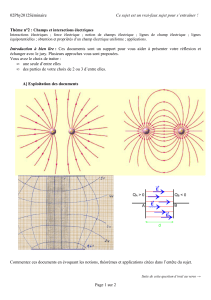
/9 ' %' )* $(& 43%!%& $% 3%&%*' !" #$%&'()*%
⃗
* ",(& 7 "*(+ *
",(&-9
!
(&',1*(&" '$%&',*+(&*#%*#$%&',7 3%*%3(&%++%#:$(:% F$%9
1!%& )*% %& #$%&',7 "$,:# 1 + $% !" #$%&'()*%
⃗
7 +*F(& *% ;,'%
#$%&'()*%
⃗
H#$%=)⃗
7,I)%+&$ ':%1%$#$%&',%&
=
1
9
9 ,%'$%+ ' &#'(+4)*%+1%$ ;,'%
⃗
H#$%
""$()*#%6$#$%&',+(&*#%9
A9 ,!" '%' $(&%+(&# 1%
⃗
H#$%
3% %$$% 1* ",(1+
⃗
1% $#$%&',9 *%$$%
;,'%%+&#:$(:% F$%@
B9 '#3,(')* $(& 43%!%&$%E%&1%+;,'%++*'$%!,*3%!%&1%$#$%&',9
"#!$%
9 ,!"$#&%' $%+#! 3%* 2% 1%+ $4&*1%+ DJG ,'(% % "'#(+ & $
'#;#'%%1%+#%':(%+",&%4%$$%+1%"%+ &%*',(+(%9
* 1 $#$%&', C%(& $,'(8% % -7 +, #%':(% !# ()*% *:!%&# 1%
K!.L7/M05NO9
A9 #%':(%!# ()*%1*+<+&=!%+%,+%'3%5&5%$$%@
B9 *%$$%%+&$ 3 '( 4,1#%':(%",&%4%$$%1%"%+ &%*'1%$#$%&',$,'+1%
+,!,*3%!%&1%3%'+-@
/9 $*$%'$#%':(%(#4)*%1%$#$%&',%-9
9 1#1*('%$ 3(&%++%1%$#$%&',%-9
&#!%'
#$%&', +,'& 1% $,'(8% - 3% *% 3(&%++% 3- . 7PM0N !9+59 * F,*& 1%
K& . 700M05 L +7 ($ " ',*'& *% 1(+& % % F+(++% K2 . 7PM0 ! ",*'
C%(1'% $%",(&9 3 '( 4,1#%':(%(#4)*%)*($+*F(&%&'% -%& %+&
$,'+#: $%6K./7BPM05BO9
9 *%$$%D+G;,'%D+G+ ""$()*%D&G *+<+&=!%@
A9 #%':(%!# ()*%1*+<+&=!%+%,+%'3%5&5%$$%@
B9 $*$%'$ "%'&%1 $4&*1%KJ.JJ-%&'%-%&9
/9 ,!" '%'KJ6K29,$*'%9

A-
F*& ,% %+& *% !,$#*$% ,': ()*%7 +,*3%& *4$(+#% 1 + $(1*+&'(%
"$ +4)*% ,!!% +,$3 &9 ()*(1% (,$,'% 6 $ &%!"#' &*'% !F( &%7 %$$%
"'#+%&%*%,1%*'"',%1%%$$%1%$ #&,%9
(!
F*& ,%7 1% ;,'!*$% F'*&% /P7 "%*& Q&'% +<+#% " ' ,2<1 4,
!# :#%1*F*& 5A5,$D/0G9
'!( $%+ '# 4;+ *4$(+#+ 1 + $(1*+&'(%7 , &',*3% $% ;%'' &% 1% ",& ++(*!
DARSD )GSH%/A5D )GG9
9 *%$:',*"%;,4,%$ "" ' T&1 +$%F*& 5A5,$@
A9 '('%$ 1%!(5#)* 4,#$%&',()*% ++,(#% *,*"$%F*& ,%UF*& 5A5,$9
B9 &)*%$(,;%'' &%"',1*(&1%+(,+;%'H%BSD )G7#'('%$ 1%!(5#)* 4,
#$%&',()*% ++,(#%6%,*"$%9
/9 1#1*('%$#)* 4,1%$ '# 4,%&'%$%F*& 5A5,$%&$%+(,+;%'' &%9
9 *%$$% *&'% %+"=% (!()*% 1,(& #%++ ('%!%& Q&'% "'#+%&% 1 + $%
!($(%*'# 4,%$",*')*%$ &' +;,'! 4, (&$(%*@
!
+*F $$,7,3%'+%F.A70!1%F*& 5A5,$"*(+;".A!1%+,$*4,
(1(8#%1%;%'' &%1%",& ++(*!6$ ,%&' 4,;".A70!,$959
"'=+A!(1% *E :%6'%V*27,1(+4$$%$%!#$ :%%&,,F4%&*%! ++%
!.7:1%$()*(1% "'=+"*'(8 4,9
9 '('%$#)* 4,1%1(++,$*4,1*;%'' &%1%",& ++(*!+,$(1%1 +$% *9
A9 *%$$%%+&$ ,%&' 4,!,$ ('%%(,+;%'' &%H%/A5D )G@
B9 #&%'!(%'$%+)* 4&#+1%! 4='%1%'# 4;+(&',1*(&%+1 +$%F $$,9
/9 & F$('*& F$% *1 3 %!%&1%$ '# 4,9
9 #&%'!(%'$ 3 $%*'1%$ 3 %!%&! 2(! $9*%$%+&$%'# 4;$(!(& &@
L9 ',",+%' * &%+& ' &#'(+4)*% "%'!%C & 1% ,8'!%' $ ; !($$% 1%
$%+"=% ;,'!#%9 #& ($$%' $% '#+*$& & )*% 1,%' (& % &%+& +*' $% "',1*(&
'#%$$%!%&;,'!#((9
N9 *%$$%)* 4%! 4='%1%F*& ,% 5&5,; F'()*#@
P9 % '%1%!%& 1*% '# 4, %+& 1#8( ,!!% $% ' "",'& 1% $ )* 4%
! 4='% 1% "',1*(& '#%$$%!%& ;,'!# +*' %$$% )*, ",*'' (& ,F&%(' +( ,
#"*(+ (&$%'# 4;$(!(& &
'=%2"
! 2
=!%2"
!! 2
92"$((&%'",*'$ '# 4,#&*1(#%9
$*$%'+ 3 $%*'9
")
81%3#'(8%'$ &*'%1*"',1*(&;,'!#7,'# $(+%*%
',! &,:' "(% +*' ,*% !(%7 3% 1%+ 1#"W&+ 1%
F*& 5A5,$ DG7 1% F*& ,% D-G7 1* "',1*(& ;,'!# 3 &
"*'(8 4,DG%& "'=+"*'(8 4,DG9
9 *%$$% %+"=% (!()*% #&# ;,'!#% $,'+ 1% %C%
+<&=+%@
A9 % "',1*(& %+&5($ "*'@ (,7 )*%$$% %+& $(!"*'%&#
"'((" $%@,I3(%&%C%(!"*'%&#@
B9 #& "%1%"*'(8 4, 5&5%$$%#&#*4$%@
++%+!,$ ('%+F*& 55,$.N/:9!,$57F*& ,%.NA:9!,$57;".XP:9!,$5
++%+3,$*!()*%+YF*& 55,$.07P:9!57YF*& ,%.07P:9!59
1
/
2
100%