Lire l`article complet

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XIII - n° 1 - janvier-février 2009
36
36
Mise au point
Anomalies génétiques de sécrétion
de l’insuline et diabète sucré
de la petite enfance
Genetic disorders leading to impaired insulin secretion
and diabetes mellitus during infancy
Kanetee Busiah*,1, Albane Simon*,1, Michel Polak*,**
Le diabète néonatal (DNN) est une maladie rare
(1 naissance vivante sur 300 000). Il constitue
une altération métabolique grave (2), caracté-
risée par des hyperglycémies modérées à sévères, liée
à l’insu sance ou à l’absence d’insuline circulante, et
dont la découverte survient entre la période néona-
tale et la petite enfance. Deux formes cliniques ont été
individualisées, en fonction de la durée de l’insulinoré-
quérance : une forme transitoire (DNNT) et une forme
permanente (DNNP). Plusieurs découvertes récentes
concernant le mécanisme moléculaire du développe-
ment pancréatique éclairent ces deux formes de DNN
(tableau). Cependant, dans 50 % des cas, aucune cause
moléculaire n’est retrouvée. Cette mise au point met
l’accent sur les anomalies génétiques qui sous-tendent
une anomalie de sécrétion de l’insuline.
DNN lié à un défaut ciblé et unique
de sécrétion de l’insuline avec cellules bêta
présentes
Mécanismes moléculaires du diabète “transitoire”
La plupart des DNNT sont sporadiques. Une histoire
familiale de diabète est retrouvée dans 33 % des cas.
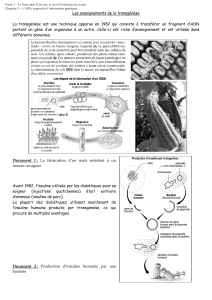
La disomie uniparentale ( gure 1), puis la duplication
partielle du bras long du chromosome 6 d’origine pater-
nelle ont été les premières anomalies génétiques qui
aient été associées au DNNT (3, 4). Ces observations,
ainsi que le mode de transmission du DNNT dans les cas
familiaux (transmission d’origine paternelle, sans qu’il y
ait forcément un retentissement clinique chez le père),
ont conduit à l’hypothèse que le DNNT résultait de la
surexpression d’un ou de plusieurs gènes. La détermi-
nation de la région chromosomique minimale dupli-
quée chez les patients a permis d’a ner la localisation
chromosomique en 6q24 (5). Un îlot CpG, présentant
une méthylation di érentielle selon l’origine parentale
(caractéristique des gènes soumis à empreinte), a alors
1 Copremiers auteurs.
* Endocrinologie pédiatrique et Inserm U845, hôpital Necker-Enfants Malades, Paris.
** Université Paris-Descartes, Paris.
Le diabète est une maladie métabolique aux multiples facteurs
»
génétiques. Certaines formes sont dues à des mutations dans un gène
unique qui conduisent à une réduction de la fonction de la cellule
bêta. Ces formes représentent 1 à 2 % de l’ensemble des diabètes
(1). Le diabète néonatal est un diabète rare qui apparaît dans les
premières semaines ou mois de vie. Deux formes sont décrites en
fonction de la durée de l’insulinorequérance. Dans le diabète néonatal
transitoire, la carence en insuline anténatale conduit à un retard de
croissance intra-utérin, la rémission survient au bout de quelques
mois, et on assiste souvent à une récidive sous forme d’un diabète
sucré de type indéterminé mais défi nitif, ce phénomène apparaissant
fréquemment au moment de l’adolescence. Il semble que l’altération de
la fonction pancréatique dans cette aff ection existe tout au long de la
vie mais s’aggrave lors des périodes de demande métabolique accrue,
notamment pendant la période néonatale, la puberté ou la grossesse.
Dans le diabète néonatal permanent, la sécrétion d’insuline devient
insuffi sante très tôt après la naissance et nécessite une insulinothérapie
tout au long de la vie. Le diabète néonatal peut être dû à une anomalie
d’une région du chromosome 6q24 soumise à empreinte, à une
mutation des gènes Kir6.2 et ABCC8 codant pour le canal potassique
ATP-dépendant, à une mutation du gène de l’insuline ou du gène de
la glucokinase. De plus, des mutations d’autres gènes (IPF1, PTF1A,
FOXP3, GLIS3, TCF2, EIF2AK3) sont à l’origine de syndromes associés au
diabète néonatal défi nitif. L’étude en biologie moléculaire des diabètes
néonataux a permis de nettes avancées dans la compréhension de la
physiopathologie, notamment de la sécrétion d’insuline, et a conduit
à l’amélioration du diagnostic et du traitement.
Mots-clés : Diabète néonatal – Sécrétion d’insuline – Cellule bêta – Canal
potassique ATP- dépendant – Kir6.2 – SUR1 – Développement.
Keywords: Neonatal diabetes – Monogenic diabetes of infancy – Insulin
secretion – Development – Potassium chanel – SUR1 – Kir6.2.
Résumé

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XIII - n° 1 - janvier-février 2009
37
37
Anomalies génétiques de sécrétion de l’insuline et diabète sucré de la petite enfance
été identi é dans cette région. Cet îlot n’est pas méthylé
sur l’allèle d’origine paternelle, alors qu’il l’est sur l’al-
lèle d’origine maternelle (4). La méthylation permet de
réprimer la transcription des gènes. Certains patients
atteints de DNNT sans autre anomalie apparente du
chromosome 6 présentent une absence complète
de méthylation de cet îlot conduisant à l’expression
anormale des deux allèles (6). Les bases génétiques
à l’origine de ce défaut de méthylation ne sont pas
connues, mais cette observation est compatible avec
une relaxation anormale de l’empreinte maternelle. À
ce jour, l’anomalie de méthylation n’a pas été retrouvée
chez les parents d’enfants atteints.
La mise en évidence de ce site de méthylation di éren-
tielle a conduit à l’identi cation de deux gènes candi-
dats, situés à proximité et exprimés exclusivement par
l’allèle paternel : ZAC (LOT1, PLAGL1) et HYMAI. ZAC
code pour un facteur de transcription mis en jeu dans la
régulation de l’arrêt du cycle cellulaire et de l’apoptose
ainsi que dans l’induction du gène du récepteur 1 du
polypeptide activateur de l’adénylate cyclase hypo-
physaire humaine (PACAP1, qui stimule fortement la
sécrétion d’insuline). La fonction de l’autre gène, HYMAI,
n’est pas connue (7). En utilisant des techniques de
transgenèse, il a été montré que la surexpression de ces
gènes dans le pancréas de souris entraînait une hyper-
glycémie transitoire chez les souriceaux (8). Néanmoins,
le lien précis entre les anomalies géné tiques et le dys-
fonctionnement de la cellule productrice d’insuline
reste à comprendre.
Mutations des sous-unités Kir6.2 et SUR1
du canal potassique de la cellule bêtapancréatique
( gures 2 et 3)
Le canal potassique sensible à l’ATP joue un rôle central
dans la stimulation de la sécrétion d’insuline en réponse
au glucose par la cellule bêtapancréatique. C’est un
octamère composé de quatre sous-unités formant la
conductance potassique proprement dite (protéine
Kir6.2, codée par le gène KCNJ11), et de quatre sous-
unités régulatrices SUR1 codées par le gène ABCC8.
Des mutations activatrices de ce canal ont été mises
en évidence dans environ 25 % des cas de DNN de la
cohorte française. Elles conduisent à des formes transi-
toires ou permanentes de DNN et touchent la sous-unité
Kir6.2, ou la sous-unité régulatrice SUR1.
Mutations du gène KCNJ11 codant
pour la sous-unité Kir6.2
Des mutations inactivatrices homozygotes du gène
KCNJ11 ont été impliquées dans des cas d’hyperinsu-
linisme. Il était logique de chercher par une image en
miroir des mécanismes d’hyperinsulinisme des muta-
tions dans le gène codant pour la sous-unité Kir6.2.
Ainsi, des mutations activatrices hétérozygotes du gène
Tableau. Causes du diabète néonatal.
Diabète néonatal transitoire
• détection d’une anomalie du chromosome 6 : maladie de l’empreinte
– duplications paternelles
– isodisomie paternelle
– anomalie de la méthylation
• pas de détection d’anomalie du chromosome 6
• mutation, en particulier du gène ABCC8 et aussi du gène KCNJ11 qui codent pour le canal
potassique de la cellule bêta : sous-unité SUR1 et Kir6.2, respectivement
Diabète néonatal défi nitif
• mutation surtout du gène KCNJ11 et aussi du gène ABCC8 qui codent pour le canal
potassique de la cellule bêta : sous-unité Kir6.2 et SUR1, respectivement
• mutation hétérozygote du gène de l’insuline compromettant le processing
de la préproinsuline
• mutation homozygote du gène de la glucokinase : insensibilité au glucose,
diabète MODY 2 chez les parents
• hypoplasie pancréatique sévère liée à une mutation du gène IPF1 (PDX1)
• syndrome IPEX et mutation du gène FOXP3 (scurfi ne) : auto-immunité diff use
• dysplasie épiphysaire associée : syndrome de Wolcott-Rallison et mutation du gène EIF2AK3
• syndrome diabète néonatal, hypoplasie du pancréas et mutation du gène PTF1A
• syndrome diabète néonatal, glaucome, hypothyroïdie congénitale
et mutation du gène GLIS3
• possible lien avec une infection entérovirale
• maladie mitochondriale
Figure 1. Schéma des mécanismes chromosomiques du diabète néonatal transitoire par anomalie du chromosome 6.
Enfant normal
Non méthylé
Méthylé
Chromosome
d’origine paternelle
Chromosome
d’origine maternelle
Isodisomie
paternelle
Augmentation du dosage
de l’allèle paternel
Relaxation
de l’allèle
maternel
Défaut
de méthylation
Duplication du
chromosome 6 paternel

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XIII - n° 1 - janvier-février 2009
38
38
Mise au point
KCNJ11 ont été mises en évidence (9, 10). Ces mutations
dominantes conduisent à un phénotype dépendant du
type de mutation allant du DNNT à un DNNP et même
à un phénotype plus sévère, associant un DNNP à des
troubles neurologiques, regroupé dans le syndrome
de DEND (diabetes epilepsy neurological defect) [11].
Ces patients ont un trouble de la fonction de sécrétion
de la cellule bêta. Des analyses électrophysiologiques
ont permis de révéler que lorsque la protéine Kir6.2 est
mutée, il y a une diminution de la sensibilité à l’ATP. Le
mécanisme intime de ce DNN est donc l’absence de
capacité du glucose à entraîner une activation de la
conductance potassique par une sensibilité réduite
à l’ATP. Cela entraîne une incapacité à dépolariser la
membrane de la cellule bêta et donc à activer les canaux
calciques voltage-dépendants. Cette non-activation
des canaux calciques a pour conséquence l’incapacité
à sécréter de l’insuline par la cellule bêta. La plupart
des patients ont un petit poids de naissance, ce qui
souligne le rôle crucial de la sécrétion d’insuline dans
la croissance pondérale fœtale.
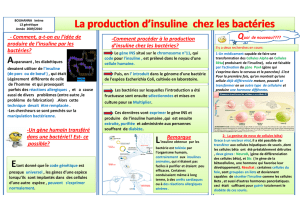
Figure 2. Le rôle des canaux K+(ATP) dans la régulation métabolique.
Chez les sujets sains, en situation de normoglycémie, il y a peu d’entrée de glucose dans la cellule bêta. Le rapport ATP/ADP est faible, conduisant à une ouverture du canal potassique. Cela entraîne une
hyperpolarisation de la membrane plasmique, ce qui provoque une fermeture du canal calcique voltage-dépendant, empêchant l’entrée de calcium dans le cytoplasme. Il n’y a pas de sécrétion d’insuline.
En situation d’hyperglycémie, le rapport ATP/ADP est élevé et conduit à une fermeture du canal potassique. Il y a donc dépolarisation de la membrane plasmique, entraînant une ouverture du canal calcique
voltage-dépendant et donc une sécrétion d’insuline.
Glucose
Élévation
du glucose
Glycémie basse Glycémie élevée
Sujet normal
Faible synthèse d’ATP
Libération
d’insuline
Canal K+(ATP) fermé
Glucose
Glucokinase
Dépolarisation
Hyperpolarisation
Glucose
Glucose
Noyau
Noyau
ATP
K–
K+
– 70 mV
Ca2+
Ca2+
Ca2+
MgADP
MgADP
ATP
Figure 3. Une nouvelle étiologie pour le diabète néonatal : anomalies fonctionnelles du canal K+(ATP).
Le canal potassique présentant une anomalie fonctionnelle ne répond pas aux variations de la concentration d’ATP et
reste constamment ouvert, empêchant toute sécrétion d’insuline en réponse au glucose.
Glucose
Glucose
Noyau
Élévation
du glucose
Diabète néonatal
Hyperpolarisation
– 70 mV
Ca2+
ATP
MgADP
K–
Canal K–(ATP) ouverts
Pas ou peu
de libération
d’insuline

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XIII - n° 1 - janvier-février 2009
39
39
Anomalies génétiques de sécrétion de l’insuline et diabète sucré de la petite enfance
Des cas de DNNT ont également été décrits avec des
mutations du gène KCNJ11, mais dans une plus faible
proportion (12 % dans la cohorte française). Aucune
corrélation génotype-phénotype n’a pu être dégagée
jusqu’à présent et aucune des caractéristiques clini-
ques recueillies ne permet de distinguer le groupe des
patients porteurs de la mutation du groupe de ceux
qui n’en sont pas porteurs. Néanmoins, dans le travail
de Vaxillaire et al. (10), 2 des 9 patients non porteurs
d’une mutation avaient un poids de naissance inférieur
au 5
e
percentile contre 6 des 9 patients porteurs d’une
mutation.
Mutations du gène ABCC8 codant
pour la sous-unité SUR1
En 2006, le gène du récepteur aux sulfamides SUR1
a été séquencé (12). Actuellement 11 % des enfants
de la cohorte française ont une mutation hétéro-
zygote activatrice du gène ABCC8, dont 50 % sont
transmises par l’un des parents. Soixante-quinze pour
cent des enfants ont un DNNT. En temps normal, la
sous-unité SUR1 diminue la capacité de fermeture du
canal potassique. En cas de mutation activatrice de
SUR1, la sensibilité à l’ATP est inchangée. En revanche,
le canal potassique a une probabilité plus grande
de rester ouvert et donc de bloquer la sécrétion de
l’insuline.
Aspects thérapeutiques dans le cas
des anomalies du canal potassique
Ces patients ne répondent pas à l’administration de
glucose ou de glucagon par une sécrétion d’insu-
line. Cependant, la majorité d’entre eux sont capa-
bles de répondre aux sulfamides hypoglycémiants,
dont l’action passe par une liaison à la sous-unité
régulatrice du canal potassique SUR1 (13). Les canaux
mutés restent sensibles aux sulfamides, qui ont un
e et inhibiteur sur le canal potassique de la cellule β
pancréatique.
Cela laissait envisager une alternative à l’insulinothé-
rapie de ces enfants avec anomalie de la sous-unité
du canal potassique, que l’on croyait dé nitive, en lui
substituant un traitement oral par un sulfamide hypo-
glycémiant. Ce dernier point a aussi été con rmé en
2006 par une étude montrant la possibilité d’arrêter
l’insulinothérapie dans un groupe de 44 patients sur
49 présentant une mutation Kir6.2 (13). Un protocole
est actuellement en cours à l’hôpital Necker-Enfants
Malades, pour permettre aux enfants de béné cier
de ces avancées thérapeutiques, les sulfamides hypo-
glycémiants étant contre-indiqués chez l’enfant en
France.
DNN permanent et transitoire :
un même mécanisme moléculaire ?
La di érence clinique entre DNNT et DNNP n’est pas
toujours sous-tendue par des mécanismes moléculaires
distincts. Les anomalies de la sous-unité Kir6.2, de même
que celles de la sous-unité SUR1 du canal potassique,
ont pu être associées à la fois à des formes transitoires et
permanentes (12, 14). Il faut noter que, si les mutations
de KCNJ11 sont associées à des formes souvent très
précoces de diabète, avant six mois de vie, la variabilité
d’apparition du diabète des formes associées à ABCC8
est plus grande. Le spectre des modes de présenta-
tion peut être très variable, allant de l’acidocétose du
nourrisson au diabète gestationnel et au diabète de
type 2 de l’adulte.
Mutations du gène de l’insuline
Très récemment des mutations hétérozygotes du gène
de l’insuline ont été reliées au DNNP. L’insuline, synthé-
tisée par la cellule bêta est formée de deux chaînes
polypeptidiques A et B reliées par des ponts disulfure.
Ces deux chaînes dérivent d’une seule chaîne précur-
seur, la proinsuline. Cette dernière est convertie en
insuline par clivage enzymatique d’un segment C qui
relie l’extrémité N terminale de la chaîne A à l’extrémité
carboxy-terminale de la chaîne B. Le phénotype des
formes associées à des mutations du gène de l’insuline
est très variable. Les premières descriptions cliniques
remontent à 1976, année lors de laquelle une hyper-
proinsulinémie asymptomatique, transmise sous le
mode autosomique dominant a été décrite (15). Par
la suite, des cas de diabète de type 2 ont été associés
à ces anomalies, puis récemment des cas de MODY
(diabète de la maturité apparaissant dans l’enfance :
maturity onset diabetes in the youth) [16], et en n des
cas de DNNP ou de diabète apparaissant dans la petite
enfance (16, 17). La proinsuline anormale serait dégra-
dée dans le réticulum endoplasmique qui serait soumis
à un stress potentiellement létal pour la cellule bêta. Ce
processus a été décrit dans des modèles de souris (18)
et il est aussi très probable chez l’homme (19).
Anomalies à l’état homozygote du gène
de la glucokinase
Une forme de diabète de type MODY, le MODY 2, est
liée à des mutations hétérozygotes du gène de la
glucokinase et se manifeste habituellement par une
hyperglycémie modérée (20). La glucokinase est res-
ponsable de la première étape du métabolisme du
glucose dans la cellule bêta permettant la synthèse du
pyruvate. Il agit ainsi comme un “sensor” contrôlant la
quantité d’insuline sécrétée. Des enfants nés de parents

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XIII - n° 1 - janvier-février 2009
40
40
Mise au point
hétérozygotes pour une mutation inactivatrice de la
glucokinase peuvent être homozygotes avec un dé cit
complet de la glycolyse. C’est ce qui a été retrouvé dans
deux familles comportant plusieurs sujets diabétiques
dont deux cas de DNNP diagnostiqués au premier jour
de vie (20). Il ne s’agit pas d’une cause fréquente de
DNNP (21, 22). Toutefois, un dosage de la glycémie à
jeun chez les deux parents est nécessaire, en parti-
culier en cas d’antécédent de diabète de la grossesse.
La découverte d’une intolérance discrète au glucose
chez les deux parents doit alors conduire à un examen
de dépistage à la recherche de mutations du gène de
la glucokinase.
Syndromes cliniques avec un DNNP non lié à un
défaut ciblé et unique de sécrétion de l’insuline
Anomalies des gènes des facteurs
de transcription du pancréas
Agénésie du pancréas et gène IPF-1
✓
(insulin pro-
moter factor-1) : la première observation décrite est
celle d’un enfant qui avait une agénésie pancréatique
avec insu sance pancréatique endocrine et exocrine
sévère. Des études avaient montré que chez la souris
l’invalidation ciblée du gène de l’IPF-1 correspondant
avait provoqué des troubles graves du développement
pancréatique endocrine et exocrine (23), et d’autres
résultats étaient en faveur d’un e et régulateur de l’IPF-1
sur l’expression des gènes de l’insuline et de la somatos-
tatine (24). Il a e ectivement été retrouvé une délétion
d’un nucléotide dans le codon 63 du gène IPF-1 (25)
à l’état homozygote chez cet enfant. Les parents étaient
hétérozygotes pour la mutation, et l’isoforme mutante
tronquée du gène IPF-1 agissait comme un inhibiteur
dominant négatif de l’activité du gène IPF-1 (20). La
mutation hétérozygote de IPF-1 est responsable du
diabète MODY 4.
Hypoplasie pancréatique, agénésie du cervelet
✓
et gène PTF1A (pancreas speci c transcription fac-
tor, 1A) : l’association d’un DNN et d’une hypoplasie
cérébelleuse, probablement de transmission autoso-
mique récessive, a été décrite chez trois membres d’une
famille consanguine. Les trois enfants sont décédés
dans les premiers mois de vie en raison de troubles
métaboliques, d’altérations de la fonction respiratoire
et, semble-t-il, d’infections graves (26). Plusieurs acti-
vateurs spéci ques de la transcription, qui régulent
l’expression génique, sont présents à la fois dans les
cellules β et dans les neurones (27). Ce syndrome, lié à
des mutations dans un facteur de transcription PTF1A,
crucial dans la morphogenèse du pancréas, associe une
hypoplasie du pancréas à une microcéphalie liée à une
hypoplasie du cervelet (28).
GLIS family zinc nger protein 3 (Glis3) ✓ : des muta-
tions dans le gène Glis3 expliquent une forme syndro-
mique de DNN associé à une hypothyroïdie congénitale,
une dysmorphie faciale et, de façon inconstante, à un
glaucome congénital, des kystes rénaux et une brose
hépatique (29). Glis3 appartient à la super famille GLIS
et agit comme activateur et répresseur de la trans-
cription.
Destruction des cellules bêta
Syndrome IPEX et gène FOXP3 : anomalies de
✓
l’auto-immunité : plusieurs auteurs ont décrit un
syndrome lié à l’X, caractérisé par l’association d’une
dermatite exfoliatrice, d’une diarrhée réfractaire avec
atrophie villositaire, d’une anémie hémolytique, d’une
thyroïdite auto-immune et d’un DNN. La plupart des
enfants qui en sont atteints décèdent d’infections gra-
ves avant d’atteindre un an (30). Une agénésie des îlots
de Langerhans a été décrite dans certains cas (31). La
possibilité d’un mécanisme auto-immun a été étayée
par l’e cacité apparente de la ciclosporine dans un
ou deux cas (32) et par la présence d’anticorps spé-
ci ques de la décarboxylase de l’acide glutamique
(GAD, glutamic acid decarboxylase) avant une gre e
de moelle. Le conditionnement pour la gre e avait
provoqué la disparition du diabète une semaine avant
la gre e, suivie par une régression de la diarrhée et
des lésions cutanées. Après deux ans de rémission,
un syndrome hémophagocytaire était apparu, pro-
voquant le décès (33). La mutation responsable de
cette maladie se situe dans le gène FOXP3 (34). Une
mutation du gène FOXP3 chez la souris scurfy conduit
à une prolifération excessive des lymphocytes T CD4+/
CD8–, qui in ltrent de nombreux organes. Les mâles
meurent 15 à 25 jours après la naissance (35). Il a été
démontré que la protéine codée par ce gène, la “scur-
ne”, était indispensable à une homéostasie normale
du système immunitaire.
Syndrome de Wolcott-Rallison et gène EIF2AK3 :
✓
anomalie de la phosphorylation des protéines : le
syndrome de Wolcott-Rallison est une a ection auto-
somique récessive caractérisée par l’apparition d’un
diabète dans la petite enfance (souvent en période
néonatale) et par une dysplasie spondylo-épiphysaire.
Il peut être associé à d’autres anomalies : hépatoméga-
lie, retard mental et insu sance rénale, et l’évolution
peut être rapidement mortelle (36). Le gène EIF2AK3,
fortement exprimé dans les cellules bêta, contribue à
la régulation de la synthèse protéique (37). En réponse
aux agressions exogènes, les cellules réduisent leur
synthèse protéique en phosphorylant la sous-unité
alpha de l’EIF2 (facteur initiateur de la traduction chez
 6
6
 7
7
1
/
7
100%