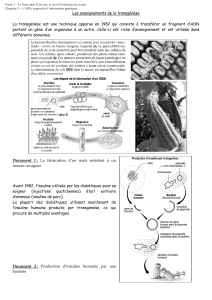
Techniques de transgénèse

Techniques de transgénèse
Comment faire un transgène ?
Pour construire un transgène il faut d'abord construire le cDNA correspondant (ADN codant
pour le gène). On isole à cet effet les ARNm du cytoplasme en les reconnaissant par leur
queue poly-AAAA et on utilise une transcriptase reverse pour créer les ADN simple brin
correspondants.
Par la méthode de la PCR on amplifie le segment d'ADN qui reconnait les amorces (d'une
vingtaine de nucléotides de long) utilisées, celles qui sont spécifiques du gène auquel on
s'intéresse. On obtient ainsi de l'ADN bicaténaire correspondant au gène d'intérêt.
Un transgène contient non seulement le cDNA codant pour la protéine d'intérêt mais aussi un
certain nombre d'informations qui vont lui permettre de s'exprimer correctement:
- un translation starting point (signal de début de transcription) qui forme le site CAP (coiffe)
de l'ARN en 5'. Ce site est souvent cloné (au sens de clonage moléculaire) en même temps
que le promoteur
- un promoteur qui permet la fixation de l'ARNpolymérase , il s'agit souvent d'une boîte TATA
(séquence du type TTATAA) ou une boîte CAT (séquence du type CAAAT)
- un terminateur qui permet le décrochage du complexe de transcription, il s'agit d'une
séquence poly AAA que l'on retrouve sur tous les ARN messagers avant leur maturation
Un transgène formé avec ces seuls éléments n'est en général pas exprimé. Il faut ajouter un
enhancer (amplificateur) que l'on peut mettre en amont ou en aval de cette construction, sa
place importe peu. Son rôle est de recruter des facteurs activateurs de transcription (des
protéines nucléaires).
De plus, l'endroit où s'intègre le transgène dans le génome hôte peut influencer sur sa lecture.
En effet des éléments en amont ou en aval de sa zone d'intégration peuvent interagir avec lui.
C'est pourquoi on adjoint à cette construction génique un isolateur, qui va servir de barrière
entre loci.
Enfin la transgénèse conditionnelle consiste à placer une élément supplémentaire dans le
transgène qui reprimera ou entraînera son expression sous l'effet d'un signal extérieur. Cela est
fortement intéressant lorsqu'on veut faire une comparaison entre animaux exprimant ou pas un
transgène (tous les facteurs impliqués dans l'expérience sont identiques sauf pour l'expression
finale du transgène) ou lorsque le transgène qui doit s'exprimer est nocif pour la celllule, son
expression sera ainsi momentanée. On utilise par exemple la tétracycline dans des système
TET-ON (déclenchement de l'expression par la présence de tétracycline) ou TET-OFF (effet
inverse).
Schéma d'un transgène

L'expression des gènes est contrôlée par des séquences situées essentiellement en amont des gènes. Le
promoteur participe directement à la formation du complexe de transcription. Les amplificateurs (enhancer)
augmentent la fréquence de fonctionnement du promoteur. Les régions éloignées MAR, ouvreur de chromatin
et isolateur, maintiennent la chromatine ouverte et empêchent l'extinction des gènes par la chromatine
environnante. Les régions UTR (untranslated region) se retrouvent dans l'ARNm, mais ne seront pas traduites.
(diapositive Louis-Marie Houdebine, INRA)
La transgénèse "au hasard"
Une technique très répandue consiste à injecter le gène (plusieurs milliers de copies du
transgène sont injectés dans le pronucleus mâle) dans l'oeuf au stade une cellule, directement
dans le pronucleus mâle, le plus gros et le plus proche de la surface. L'embryon commence sa
segmentation et est introduit dans une mère porteuse où il termine son développement. En
moyenne seulement 1 à 10% des animaux nés expriment le transgène.
Micro-injection de milliers de copies du
transgène dans le pronucleus mâle d'un
ovocyte de lapin (le pronuceus femelle est
partiellement caché par le pronucleus mâle et
les deux GP sont visibles vers le bas de la
cellule)
Photo P. Chesné INRA

La transgénèse ciblée
Il est possible de faire une transgénèse ciblée, par recombinaison homologue. Ceci consiste à
non pas ajouter un gène qui s'intègre n'importe où dans le génôme, ce qui peut avoir des
conséquences imprévisibles pour la cellule, mais à le faire se placer au locus voulu dans
l'ADN. C'est une des méthodes qui permet l'inactivation spécifique d'un gène (gène-KO), afin
d'en connaître le rôle précis.
Exemple d'une recombinaison homologue
Recombinaison homologue permettant d'intoduire le gène neo . Le rôle du gèneTk est de
pouvoir discriminer les cellules ayant intégré le transgène de façon aléatoire de celles l'ayant
intégré par recombinaison homologue.
En effet, si le vecteur s'intègre au hasard dans les cellules, le gène Tk est intégré aussi et il
s'exprime en provoquant une sensibilité des cellules à un agent toxique (le gancyclovir). Si le
vecteur est intégré par recombinaison homologue, le gène Tk n'est pas intégré et les cellules ne
deviennent pas sensibles. L'action du gancyclovir permet alors de discréminer les deux types
de cellules et de garder uniquement celles ayant intégré le vecteur par recombinaison
homologue.(diapositive Denise Aubert, PBES)
Association de la technique de transgénèse à celle du clonage (au sens de transfert
nucléaire)
Depuis que l'on sait cultiver des cellules somatiques suffisamment longtemps, il est possible
de les modifier durant leur culture in vitro. On transfère donc le transgène dans les
fibroblastes en culture (c'est à ce moment que l'on peut pratiquer une transgénèse ciblée) et
c'est l'une de ces cellules modifiées qui est utilisée comme donneuse de noyau par transfert

nucléaire sur un ovocyte.
Après fusion et activation l'oeuf génétiquement modifié ainsi créé (toutes les cellules de
l'embryon sont transgéniques) est replacé dans une mère porteuse.
Le rendement d'animaux transgéniques ainsi obtenu est considérablement augmenté (environ
50%). Il faut également deux à trois fois moins de mère porteuses que dans la méthode
précédente.
Une technique de transgénèse assez ancienne implique l'utilisation de cellules modifiées,
porteuses d'un gène étranger véhiculée par un rétrovirus. Ces cellules sont introduites sous la
zone pellucide (à travers cette dernière) d'un embryon en cours de segmentation au stade deux
celulles (voir le film de l'INRA intitulé "Transfert de gènes", sur des embryons de lapin). Ces
cellules fusionnent ensuite avec les blastomères. Toutes les cellules de l'embryon ne sont pas
forcément modifiées.
Chez les espèces pour lesquelles on a isolé et cultivé des cellules embryonnaires souches (la
souris par exemple), on peut utiliser des cellules ES modifiées pour créer un animal
génétiquement modifié. Les cellules ES modifiées sont transférées directement dans la cavité
du blastocyste ce qui donnera un organisme chimère dont certaines cellules sont modifiées et
pas d'autres. Cependant la répartition des cellules ES (migration) se faisant dans tous les types
de tissus au cours du développement embryonnaire, l'ensemble des tissus de l'animal parait
transgénique. Croisé à des souris suvages ces animaux transgéniques chimères donneront des
transgéniques hétérozygotes.
Injection de cellules ES de
souris modifiées (par
recombinaison homologue)
dans la cavité d'un
blastocyste de souris.
Photo D. Aubert ENS-Lyon
Transplantation d'embryons génétiquement modifies dans une mère porteuse (lapin)

Embryons
transgéniques de lapin
au stade une cellule,
observés à la loupe
binoculaire.
Photo F. Jauzein
INRP/labo INRA
Une dizaine de ces
embryons est contenue
dans la goutte de
milieu située à
l'extrêmité de la pipette
ayant servi à leur
aspiration.
Photo F. Jauzein
INRP/labo INRA
Ces embryons sont
placés dans une lapine
porteuse. On voit ici le
champ opératoire avec
la vessie (rabattue vers
le bas) de l'animal, et la
pipette dirigée vers
l'une des trompes
utérines.
Photo F. Jauzein
INRP/labo INRA
L'ovaire apparaît rouge
sombre au centre de
l'image. La pipette
contenant les embryons
est glissée dans la
trompe, maintenue
(ainsi que des tissus de
soutien) entre les doigts
de la technicienne.
Photo F. Jauzein
INRP/labo INRA
Comment prouver la présence d'un transgène ?
Technique d'électrophorèse d'ADN permettant de déceler la présence d'une séquence d'ADN
recherchée (par exemple lors d'un contrôle sur un aliment susceptible de contenir un
transgène). Le fait de déceler la présence du transgène ne présume en rien de son expression.
Recherche de la présence d'un transgène de
porc (gène WAP pour Whey Acid Protein,
d'une protéine du petit lait) dans des cellules de
souris (électrophorèse d'ADN après PCR,
segments les plus légers, 100pb, au bas des
colonnes).
Le temoin positif est à droite. L'eau, notée E,
sert de témoin négatif.
Les animaux 239 et 240 (en haut à gauche), par
exemple, ont intégré le transgène, mais pas les
241 et 242.
La bande claire présente chez tous les
animaux , à la base de la colonne, correspond
aux amorces utilisées dans la PCR.
Photo C. Morgenthaler INRA
On ne pourra savoir qu'un animal est transgénique de façon mosaïque (seules certaines de ces
cellules sont transgéniques), que par le taux d'animaux transgéniques dans sa descendance,
qui sera inférieur à 50%. En effet un animal dont toutes les cellules sont transgéniques, donne,
une fois croisé avec un animal sauvage, 50% d'individus transgéniques. Si jamais on trouve
 6
6
1
/
6
100%