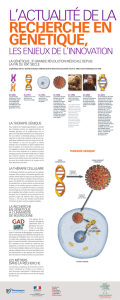
A propos de la thérapie génique

14
Depuis un demi-siècle bientôt, il est
connu que des maladies existent,
qui sont dues à des variations dans
un gène. A titre de premier exemple,
la science a été capable d’identifier
l’anémie à cellules falciformes, où
la mutation d’un module de la subs-
tance héréditaire a pour consé-
quence une molécule d’hémoglobine
modifiée qui, sur la base de sa
nouvelle configuration, s’agglutine si
spontanément que les cellules san-
guines porteuses de cette molécule
prennent la forme de faucilles.
En rapport direct avec cette décou-
verte, l’idée est apparue de soigner
une maladie génétique en rempla-
çant le gène modifié par la version
normale que l’on trouve dans une
personne en bonne santé. Au début
des années soixante déjà, on a uti-
lisé pour cela le mot «thérapie gé-
nique», et même si à l’époque, des
connaissances fondamentales sur la
structure du matériel génétique fai-
saient encore défaut et si personne
ne savait comment s’y prendre –
l’idée d’une thérapie à partir et avec
des gènes a eu un effet si convain-
cant pour une pensée axée sur les
causalités qu’il sembla que tôt ou
tard, dite thérapie deviendrait réalité
et serait offerte aux patients.
Mais nous nous demandons encore
à l’heure actuelle quand ce temps
arrivera – si tant est qu’il vienne une
fois – car, en dépit de tous les pro-
nostics audacieux des années 80 et
un premier petit succès dans les
années 90, les chercheurs qui tra-
vaillent de nos jours sur la thérapie
génique doivent répondre davantage
à des questions suscitée par le scep-
ticisme que par la curiosité. Bien
que dans l’intervalle, depuis plus de
quinze ans, des thérapies géniques
assorties de résultats changeants
ont été testées dans des études cli-
niques, il n’est pas question d’une
large application de la procédure
établie sous cette notion, au regret
général d’ailleurs.
Le premier succès, plutôt modeste,
qui est mentionné ci-dessus et
encore cité aujourd’hui comme cas
modèle, remonte à l’an 1990, alors
que la faiblesse immunitaire de nais-
sance d’une fillette de quatre ans
portant le nom de Ashanti de Silva a
été traitée de telle sorte que ses
lymphocytes, après prélèvement, ont
été modifiés génétiquement au point
qu’ils ont pu reprendre ensuite leur
fonction normale dans la défense
immunitaire du corps. La fillette
souffrait de la maladie portant le
nom de déficience de l’enzyme adé-
A propos de la thérapie génique
Une idée simple avec de premiers succès
et une mise en œuvre difficile
Prof. Dr Ernst Peter Fischer,
Université de Constance,
Consultant Gen Re LifeHealth

15
nosine désaminase (ADA) et qui si-
gnifie précisément qu’un enzyme fait
défaut au corps, à savoir l’enzyme
dénommé adénosine désaminase.
Sur cette toile de fond, l’ADA est
apparue indiquée, malgré sa rareté,
pour une thérapie génique. Celle-ci
a été exécutée dans des cliniques
universitaires de la côte Est des
Etats-Unis et a probablement réussi
puisque la fillette se porte bien
aujourd’hui et que tous les signes
montrent en outre qu’elle dispose
de suffisamment de lymphocytes
intacts lui permettant une vie nor-
male. Toutefois, la critique ne se tait
toujours pas face à cette allégation
car, dès le départ, Ashanti a égale-
ment reçu (sous une forme spéciale)
l’enzyme manquant lui-même; mais
que ceci ne soit mentionné ici qu’à
titre marginal.
Il est notamment clair depuis lors
qu’une thérapie génique peut fonc-
tionner sous la forme testée sur
Ashanti, puisque chez des patients
souffrant de granulomatose chro-
nique, il a été montré à l’évidence
durant les années suivantes que,
s’agissant de maladies monogènes,
un gène qui ne fonctionne pas peut
être remplacé par un qui fonctionne
et que la maladie peut donc être
traitée ainsi à son origine (causale-
ment), comme on l’a toujours sou-
haité.
Dans la présentation faite jusqu’à
ce point, nous n’avons pas pris en
considération la question technique
de savoir comment le gène souhaité
peut être amené dans les cellules
qui en ont besoin et qui doivent le
restituer au corps des patients (et en
fait de telle manière qu’elles com-
mencent ensuite à s’y établir et à y
mener une vie normale avec des par-
titions de cellules en continu). Dans
le cas pionnier exposé, on a choisi la
méthode où un virus est utilisé en
tant que vecteur de gène, lequel a
été isolé auparavant par des moyens
du génie génétique et auquel on a
ajouté des gènes désirés clonés. Un
problème surgit alors immédiate-
ment, car les virus sont avant tout
connus pour pouvoir développer leur
propre existence dans des environ-
nements appropriés et charger sur
le plan toxique l’organisme en voie
de guérison. En réalité, chez des
patients qui doivent être traités pré-
cisément en raison d’une faiblesse
immunitaire (SCID X1), des leucé-
mies apparaissent au cours de la
thérapie génique. La seule raison
autorisant les médecins ou cher-
cheurs à risquer cet effet très dange-
reux pour le patient réside dans la

16
réalisation que le SCID 1X est une
menace pour la vie et que les en-
fants traités devraient mourir à dé-
faut d’une thérapie génique.
En dépit des risques connus, l’immi-
gration à l’aide de virus demeure
malheureusement le moyen de l’op-
tion, bien qu’il existe de nombreuses
méthodes opératoires plus physi-
ques, où les membranes des cellules
sont rendues perméables, pour ap-
porter le gène souhaité à l’endroit
où il doit agir. Seules des références
peuvent être indiquées ici au sujet
de cette option et des détails de
l’utilisation de virus (davantage de
données peuvent être trouvées dans
la littérature).
Les remarques faites à ce stade
montrent clairement que l’idée –
considérée comme une simplicité
efficace à l’origine – d’un remplace-
ment de gènes, respectivement d’un
échange de gènes ne demeure nulle-
ment simple lorsqu’il s’agit de la pra-
tique médicale et quiconque désire
développer une thérapie génique
complète et assurer son admission
sur le plan pratique doit étudier en
détail plusieurs étapes qui compor-
tent toutes des difficultés et peuvent
faire échouer la procédure. D’abord,
il faut identifier le transporteur de
gène idoine qui est dénommé vec-
teur dans le langage spécialisé.
Ensuite, il y a lieu de rechercher de
surcroît la stratégie adéquate de
traitement et le mode optimal d’ap-
plication. Et pour tout cela, il existe
comme auparavant la possibilité de
finir par découvrir la variante res-
pectivement correcte (meilleure) des
gènes utilisés pour la thérapie. Une
entreprise pénible et souvent ris-
quée, qui exige la plus grande pru-
dence et attention ainsi que des
contrôles.
L’énumération donnée montre nette-
ment que toute thérapie génique
doit être testée minutieusement et
complètement dans des études cli-
niques et, l’an dernier, on a pu voir
dans la littérature que plus de
1000 études sur des thérapies gé-
niques ont été mandatées et en-
tamées. La majeure partie d’entre
elles – plus de 700 expérimentations
– se sont focalisées sur des maladies
cancéreuses, car leur base géné-
tique est incontestée et comprise
dans de nombreux cas. Près de cent
études se sont penchées sur des
maladies des vaisseaux ou des mala-
dies infectieuses dont les infections
HIV font partie. Dans les études exa-
minant le HIV, des lymphocytes sont
utilisés qui portent un gène anti-HIV.
Dans ces études s’appliquent des

17
critères de choix stricts, ce qui signi-
fie surtout que seules peuvent être
inclues dans les expérimentations
des personnes qui sont déjà attein-
tes par le SIDA et pour lesquelles
aucune alternative thérapeutique
n’est connue.
Celui qui s’intéresse à une répar-
tition sous l’angle géographique des
études de thérapies géniques en
trouvera deux tiers aux USA et moins
d’un tiers en Europe. S’agissant de
l’Allemagne, la revue des médecins
a utilisé pour cela l’expression «un
pays plutôt sur la réserve», et elle
cite à ce sujet (état: fin sept. 2005)
le «Deutsche Register für Somati-
sche Gentransfer-Studien» (DeReG),
qui mentionne 40 études dans les-
quelles ont participé 361 patients.
A l’échelle mondiale, ce sont plus
de 1000 études portant sur plus de
6000 patients qui ont été annoncées
et entreprises jusqu’ici. (Le registre
des thérapies géniques se trouve sur
Internet sous l’adresse www.dereg.
de).
Parmi les plus grands espoirs de la
thérapie génique, on compte, hormis
l’aide apportée dans le cancer, l’utili-
sation en cas de mucoviscidose dont
la cause est un gène identifié dans
l’intervalle. La mucoviscidose est
diagnostiquée chaque année en Alle-
magne chez 200 personnes environ,
et on pensait aider celles-ci sur le
plan de la thérapie génique, après la
découverte du gène de la maladie,
qui est dénommé CFTR. Le gène aide
le tissu à se transformer en un canal
chloride, et son dysfonctionnement
fait sécher la muqueuse qui peut
être colonisée ensuite par des bacté-
ries et subit alors une inflammation.
C’est ce qui se passe dans le pou-
mon qui est réputé bien accessible,
ce qui a encouragé l’espoir d’un suc-
cès pour la thérapie génique.
Jusqu’à présent, le bilan est de-
meuré décevant. Environ 30 études
cliniques ont été effectuées sans
succès durable, ce qui signifie plus
précisément que seule une correc-
tion provisoire de l’échange de chlo-
ride s’est produit chez les patients.
A titre de raison de cet échec, on a
notamment indiqué l’inefficacité des
vecteurs de gène ainsi que de fortes
réactions d’inflammation.
Entre-temps, de meilleurs vecteurs
de gène existent, de type non viral,
et avec lesquels une nouvelle étude
clinique a été entreprise qui inclut
200 patients; elle est coordonnée
par des Britanniques. Les chercheurs
espèrent avant tout à ce sujet l’effet
complémentaire précieux d’une en-
zyme nommée Integrase, qui doit

18
stabiliser l’intégration du gène cor-
rigé dans les cellules cibles et pro-
curer ainsi une expression génique
durable. Par ailleurs, il y a d’autres
nouvelles approches de la thérapie
génique pour la mucoviscidose, de
sorte qu’il faut admettre, l’un dans
l’autre, qu’il sera possible de dé-
velopper dans un avenir pas trop
éloigné une procédure qui fonc-
tionne pour ce cas.
Les efforts actuellement entrepris
pour lutter contre la mucoviscidose
seront encouragés par des moyens
de l’UE qui s’efforce en outre d’éta-
blir une procédure d’autorisation
centralisée pour les thérapies gé-
niques auprès de l’Agence euro-
péenne du Médicament (EMEA), afin
de rendre accessible la procédure,
de manière uniforme, à tous les
patients en Europe. Dès 2007, tou-
tes les procédures d’approbation,
disséminées jusqu’ici, seront réunies
dans un cadre juridique européen.
On remarquera que la maladie ini-
tialement envisagée, du nom d’ané-
mie à cellules falciformes, n’apparaît
plus. En réalité, son développement
s’est révélé beaucoup plus compli-
qué que ne l’avaient pensé les pre-
miers initiants de la thérapie géni-
que. Ils demeurent néanmoins opti-
mistes. 쐽
Une référence
au sujet de la littérature
Heiko von der Leyen, Claudia Wendt,
Hans Armin Dietrich (éd.):
Gentherapie und Biotechnologie –
Ansätze zu neuen Therapieformen
in der Medizin. Wissenschaftliche
Verlagsgesellschaft, Stuttgart 2005,
548 pages (ISBN 3-8047-1917-1),
69 Euro.
1
/
5
100%