Exercices

Exemples d'exercices de thermodynamique classique
1. Une masse d'air sec monte dans l'atmosphère jusqu'au niveau de 700 mb. Son niveau
de pression et sa température initiaux sont respectivement de 1000 mb et 20 °C. En
supposant que la parcelle ne se mélange pas avec son environnement et que la montée
se fait sans échange de chaleur, calculez:
a) Son volume spécifique initial.
b) Sa température et son volume spécifique finaux.
c) Le changement d'énergie spécifique et d'enthalpie spécifique.
d) Quel est le travail, par unité de volume, exécuté pendant l'ascension?
e) Quel serait le changement d'enthalpie spécifique si la même masse d'air
subissait un processus de refroidissement isobarique dans lequel elle aurait la
même température finale (20 °C)?
f) Quel serait le changement d'enthalpie spécifique si la même masse d'air subissait
un processus d'expansion isotherme dans lequel la pression finale serait de 700
mb?
2) Dans l'expérience rudimentaire d'équilibre thermique, qu'est-ce qui empêche de dire
que «de la température» passe d'un corps à l'autre?
3) Comment la pression atmosphérique est affectée par la présence de vapeur d'eau? Pour
des températures de l'air égales, où est-ce que la pression de l'air sera plus grande: sur un
désert ou sur un océan?
4) Un échantillon d'air de 50 g de masse et de volume V0 a initialement une température
de 180 K. On lui additionne de la chaleur isobariquement jusqu'à que son volume
augmente de 10% (Vf = 1.10 V0). Calculez:
a) La température finale;
b) Le travail d'expansion;
c) La quantité de chaleur additionnée à l'échantillon.
5) Une mole de gaz subit une expansion isotherme. La particule fourni de travail a
l'environnement pendant son expansion. Comme l'énergie interne d'un gaz idéal ne
dépend que de la température elle ne varie pas pendant le procédé. Il s'en suit, du
premier principe de la thermodynamique, que la chaleur absorbée par le gaz

pendant son expansion est convertie complètement en travail. Y a-t-il violation du
deuxième principe de la thermodynamique? Justifiez votre réponse.
6) Un inventeur affirme avoir construit une machine thermique cyclique qui, à chaque
cycle extrait 105 cal de chaleur de la source chaude, rejette 4 104 cal vers le
réservoir froid, et fourni 2.16 105 Joules de travail. Investirez vous dans la
commercialisation d'une telle machine? Expliquez.
7) Une masse d'air humide sous une pression de 900 mb est à une température de 2.1 °C.
Son rapport de mélange est de 3 g kg-1.
a) Calculez Tv et χ = R/cp de cette masse d'air. (1)
b) Quelle est son humidité relative? (1)
c) Quelle est sa pression partielle de vapeur d'eau? (1)
Quelle est la valeur du rapport de mélange et de la pression partielle de l'air sec si la
particule est soulevée de façon adiabatique jusqu'au niveau de 800 mb.
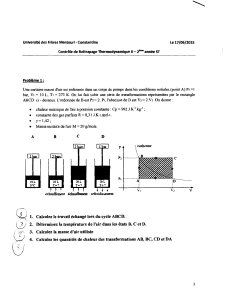
8) Considérez le processus cyclique suivant lequel une masse d'air sec, initialement à
0 °C, est soumise: (1) expansion isotherme de 70 kPa à 60 kPa, (2) refroidissement
jusqu'à -10 °C, (3) compression isotherme jusqu'à 70 kPa et (4) réchauffement
isobare jusqu'à 0 °C. Calculez:
a) Le travail effectué sur la masse d'air au cours d'un cycle.
b) La variation d'entropie, d'enthalpie et d'énergie interne.
c) La quantité de chaleur absorbée ou dégagée pendant ce processus.
9) L'expression «processus isotherme et quasi statique (réversible)» est-elle redondante?
10) Que pensez-vous des deux affirmations:
a) «La variation d'énergie interne d'un système dans un processus ne dépend que
de l'état initial et l'état final».
b) «La variation d'énergie interne d'un système dans un processus ne dépend que
de la température initiale et de la température finale»
11) Les égalités a), b) et c) ci-dessous sont relatives à un processus élémentaire d'un
système simple:
a) dU = δW+δQ
b) δQ = TdS
c) δW = -pdV
Lesquelles sont toujours vraies? Lesquelles sont vraies seulement pour un
processus quasi statique?
12) Pourquoi une détente adiabatique refroidit-elle un gaz parfait? Ce refroidissement est-
il le même pour un gaz «imparfait»?

13) Pourquoi le coefficient de chaleur spécifique à pression constante (cp) est-il plus
grande que le coefficient de chaleur spécifique à volume constante (cv)?
14) Deux échantillons identiques d'un gaz parfait subissent des compressions réversibles
de V à V/2, l'une isotherme, l'autre adiabatique. Pour laquelle la variation d'entropie
est la plus grande?
15) Une masse d'air sec s'élève dans l'atmosphère du niveau de pression 100 kPa jusqu"au
niveau de 50 kPa. En supposant que l'air ascendant ne subit pas de mélange avec l'air
environnant et n'échange de chaleur avec l'environnement, sachant qu'au départ sa
température est de 10 °C, calculez:
a) Le volume spécifique initial de cette masse d'air.
b) Le changement de son énergie interne et de son entropie spécifique.
c) Le travail par unité de masse effectué par l'air au cours de son ascension.
1
/
3
100%