TRACLEER bon usage CHU 06 05

Logo
établissement
FICHE DE BON USAGE D’UN MEDICAMENT
FACTURABLE EN SUS DE LA T2A
Commission du
médicament et
des dispositifs
médicaux stériles
Référentiel bon usage : modèle médicament
Commission des Pharmaciens de CHU
« Groupe innovations » Juin 2005 1/6
DENOMINATION DU MEDICAMENT
TRACLEER
CARACTERISTIQUES
Dénomination commune : Bosentan
Composition qualitative et quantitative : TRACLEER comprimés pelliculés à 62.5 mg et 125 mg
Statut : A.M.M. A.T.U.
Classe ATC : CO2KX01
Présentation : comprimés pelliculés à 62.5 mg et 125 mg
Laboratoire : ACTELION
Prix HT: (prix fixé par le CEPS selon l’avis relatif aux prix de spécialités pharmaceutiques publiés en
application de l’article L. 162-16-5 du code de la sécurité sociale publié au Journal Officiel du 24/12/04)
45 € le comprimé à 62,5 mg et le comprimé à 125 mg
Coût moyen de traitement : 2 756,70 € TTC /mois
HISTORIQUE DES MODIFICATIONS
Numéro de version Date d’application Nature des modifications
Version 1
VALIDATION
Rédaction Vérification Approbation
Président C.M.D.M.S.
Date :
Nom (s) :
Signature (s) :
Date :
Nom (s) :
Signature (s) :
Date :
Nom (s) :
Signature (s) :

Logo
établissement
FICHE DE BON USAGE D’UN MEDICAMENT
FACTURABLE EN SUS DE LA T2A
Commission du
médicament et
des dispositifs
médicaux stériles
Référentiel bon usage : modèle médicament
Commission des Pharmaciens de CHU
« Groupe innovations » Juin 2005 2/6
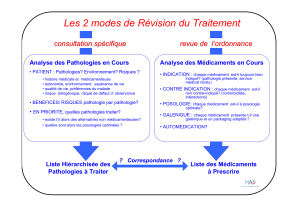
RECOMMANDATIONS DE BON USAGE
GROUPE I : Indications reconnues (AMM et protocoles thérapeutiques définis par l’Agence française de
sécurité sanitaire des produits de santé, la haute autorité de santé ou l’institut national du cancer)
Hypertension artérielle pulmonaire primitive (HTAPP) de classe III NYHA* idiopathique ou associée à une
sclérodermie (AMM)
* NYHA : New York Heart Association
AMM : OUI NON
Avis de la Commission de Transparence : Avis du 05/02/2003 ; SMR : niveau important ; ASMR : Le
bosentan (TRACLEER) partage le niveau d'amélioration du service médical rendu par l'époprosténol
(FLOLAN°) (ASMR de niveau I : majeure) chez les patients ayant une hypertension artérielle
pulmonaire primitive ou secondaire à une sclérodermie en stade III.
Pertinence scientifique : 1,2,3
RECOMMANDATIONS DE BON USAGE
GROUPE II : Indications scientifiquement validées et indications sur justification spécifique
HTAP associée à une prise antérieure de médicaments anorexigènes ou associée à d'autres maladies systémiques
(lupus, polyarthrite rhumatoïde, vascularité), à l'infection VIH ou à des cardiopathies congénitales avec shunt
gauche-droit (Syndrome d'Eisenmenger)
AMM : OUI NON
Avis de la Commission de Transparence :
Pertinence scientifique : 4
RECOMMANDATIONS DE BON USAGE
GROUPE III : Indications non validées ou autres
HTAP associée à une hypertension portale
AMM : OUI NON
Avis de la Commission de Transparence :
Pertinence scientifique :

Logo
établissement
FICHE DE BON USAGE D’UN MEDICAMENT
FACTURABLE EN SUS DE LA T2A
Commission du
médicament et
des dispositifs
médicaux stériles
Référentiel bon usage : modèle médicament
Commission des Pharmaciens de CHU
« Groupe innovations » Juin 2005 3/6
HTAP secondaire à une maladie respiratoire (BPCO, fibrose) ou à des embolies pulmonaires (HTAP
postembolique)
AMM : OUI NON
Avis de la Commission de Transparence :
Pertinence scientifique :
POSOLOGIES MOYENNES
Groupe I
Le traitement par cette spécialité sera initié à la posologie de 62,5 mg deux fois par jour pendant 4 semaines, et la
posologie sera ensuite augmentée jusqu'à la posologie d'entretien de 125 mg deux fois par jour. Les comprimés
de Tracleer seront pris par voie orale, matin et soir, au cours ou en dehors d'un repas.
En cas de détérioration clinique (telle que la diminution du test de marche de 6 minutes d'au moins 10% par
rapport à la mesure avant traitement) et ce malgré un traitement par Tracleer pendant au moins 8 semaines
(posologie d'entretien administrée pendant au moins 4 semaines), un autre traitement devra être envisagé.
Cependant, certains patients qui n'ont montré aucune réponse après 8 semaines de traitement par cette
spécialité, peuvent répondre favorablement après 4 à 8 semaines supplémentaires de traitement. Si l'arrêt de
cette spécialité est envisagé, cet arrêt devra être progressif, parallèlement à l'initiation du nouveau traitement.
En cas de détérioration clinique tardive malgré un traitement par cette spécialité (après plusieurs mois de
traitement), la prise en charge thérapeutique devra être réévaluée. La tolérance à l'effort de certains patients
répondant insuffisamment à la dose de 125 mg deux fois par jour de cette spécialité, peut parfois être légèrement
améliorée après augmentation de la posologie à 250 mg deux fois par jour. Le rapport bénéfice/risque de la
conduite thérapeutique envisagée devra alors être soigneusement évalué en tenant compte du fait que la toxicité
hépatique du bosentan est dose-dépendante.
* Interruption du traitement
Il existe peu de données concernant les conséquences de l'interruption brutale du traitement par cette spécialité.
Aucune observation n'a suggéré un effet rebond. Toutefois, afin d'éviter une détérioration clinique conséquente
d'un potentiel effet rebond, une diminution progressive de la posologie (diminution de moitié de la dose pendant
3 à 7 jours) est recommandée avant d'interrompre le traitement. Une surveillance accrue est recommandée
pendant cette période.
* Posologie chez l'insuffisant hépatique
Aucune adaptation de la posologie n'est nécessaire chez les patients atteints d'insuffisance hépatique légère
(classe A de la classification de Child-Pugh). Cette spécialité est contre-indiquée chez les patients présentant une
perturbation modérée à sévère des fonctions hépatiques.
* Posologie chez l'insuffisant rénal
Aucune adaptation de la posologie n'est nécessaire chez les patients atteints d'insuffisance rénale. Aucune
adaptation de la posologie n'est nécessaire chez les patients en dialyse.
* Posologie chez les suiets âgés
Aucune adaptation de la posologie n'est nécessaire chez les patients âgés de plus de 65 ans.

Logo
établissement
FICHE DE BON USAGE D’UN MEDICAMENT
FACTURABLE EN SUS DE LA T2A
Commission du
médicament et
des dispositifs
médicaux stériles
Référentiel bon usage : modèle médicament
Commission des Pharmaciens de CHU
« Groupe innovations » Juin 2005 4/6
* Enfants
La sécurité et l'efficacité du bosentan n'ont pas été entièrement étudié chez les enfants de moins de 12 ans.
Les posologies suivantes ont été utilisées dans l'essai AC-052-356 (BREATHE-3):
Poids corporel (kg) : 10< ou = X < ou = 20
Posologie initiale (4 semaines) : 31,25 mg une fois par jour
Posologie d'entretien : 31,25 mg deux fois par jour
Poids corporel (kg) : 20< X < ou = 40
Posologie initiale (4 semaines) : 62,5 mg une fois par jour
Posologie d'entretien : 125 mg deux fois par jour
Poids corporel (kg) : > 40
Posologie initiale (4 semaines) : 31,25 mg une fois par jour
Posologie d'entretien : 62,5 mg deux fois par jour
Cet essai était essentiellement conçu pour déterminer la pharmacocinétique du bosentan chez les enfants. Le
nombre d'enfants étudiés dans chaque groupe de dose a été insuffisant pour établir la posologie optimale chez les
sujets de moins de 12 ans. L'exposition systémique retrouvée était plus faible chez les enfants que chez les
adultes présentant une hypertension artérielle pulmonaire. Ces données suggèrent la possibilité d'un effet
incomplet sur la vascularisation pulmonaire des doses utilisées dans cet essais. Toutefois, la tolérance de
posologies supérieures administrées chez les enfants n'a pas été établie.
Aucune donnée n'est disponible chez les enfants de moins de 3 ans.
* Sujets de faible poids corporel
Peu de données concernant les patients pesant moins de 40 kg sont disponibles.
Groupe II
Groupe III
PERSONNES AUTORISEES
A prescrire (médecins habilités, avis staff ou experts)
Spécialistes
en pneumologie, cardiologie et médecine interne
A dispenser
Pharmacie Hospitalière
A administrer
IDE ou patient
ELEMENTS QUANTITATIFS
Nombre de patients estimés / an
Consommation estimée (volume, valeur)

Logo
établissement
FICHE DE BON USAGE D’UN MEDICAMENT
FACTURABLE EN SUS DE LA T2A
Commission du
médicament et
des dispositifs
médicaux stériles
Référentiel bon usage : modèle médicament
Commission des Pharmaciens de CHU
« Groupe innovations » Juin 2005 5/6
ANNEXES
Annexe N° 1 : Modalités et modèle de prescription
Annexe N° 2 : Modalités de dispensation
Annexe N° 3 : Modalités de préparation et d’administration
Annexe N° 4 : Conditions particulières de conservation
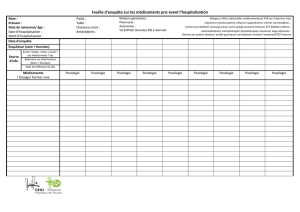
Annexe N° 5 : Tableau de suivi des patients
Annexe N° 6 : Références bibliographiques
ANNEXE N° 1
Modalités et modèle de prescription
Prescription hospitalière
ANNEXE N° 2
Modalités de dispensation
ANNEXE N° 3
Modalités de préparation et d’administration
ANNEXE N° 4
Conditions particulières de conservation
A conserver à une température ne dépassant pas + 30°C.
 6
6
1
/
6
100%