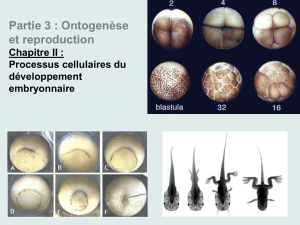
L`unité de la gastrulation chez les vertébrés - iPubli

/s 1994 ; JO: 84-91
L'unité de la gastrulation chez les vertébrés
XIX•
2).

à
à
à
à
à à
à
à
à III
à
à
à
.
à
1

______

1
TGF-�, FGF W

�
 6
6
 7
7
 8
8
1
/
8
100%